题目内容
8.工业上制取纯硅的主要反应:SiCl4+2H2═Si+4HCl.该反应中,被还原的物质是SiCl4(填化学式),作为还原剂的物质是H2(填化学式);若反应中生成了1molSi,则转移电子4mol,消耗H22mol.分析 反应SiCl4+2H2═Si+4HCl中,Si元素化合价降低,被还原,SiCl4为氧化剂,H元素化合价升高,被氧化,H2为还原剂,结合反应的化学方程式解答该题.
解答 解:反应中Si元素化合价降低,被还原,SiCl4为氧化剂,H元素化合价升高,被氧化,H2为还原剂,由方程式可知,若反应中生成了1mol Si,则消耗H22mol,转移4mol电子.
故答案为:SiCl4; H2; 4; 2.
点评 本题考查氧化还原反应,为高考高频考点,侧重于化学与工业生产的考查,有利于培养学生的良好的科学素养,提高学习的积极性,注意从元素化合价的角度解答该题,难度不大.

练习册系列答案
相关题目
18.下列各组中的两物质相互反应时,与反应条件和用量无关的是( )
| A. | Na和O2 | B. | Fe和FeCl3 | C. | Na2CO3和HCl | D. | AlCl3和NaOH |
16.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 泥浆 | B. | CuSO4溶液 | C. | 酒精溶液 | D. | Fe(OH)3胶体 |
3.下列反应既属于离子反应,又属于氧化还原反应的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 2NaOH+CO2═Na2CO3+H2O | D. | Fe+2HCl═H2↑+FeCl2 |
13.葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-).
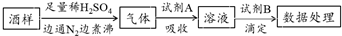
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性 | |
| B. | 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出 | |
| C. | 若试剂A选择氯水,则试剂B可选择NaOH标准液 | |
| D. | 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液 |
20.酸雨形成的示意图如图.下列说法中,不正确的是( )
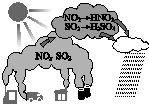

| A. | 汽车尾气是导致酸雨的原因之一 | B. | 酸雨会使土壤、湖泊酸化 | ||
| C. | 酸雨形成中不涉及氧化还原反应 | D. | 燃煤中加入石灰石可防治酸雨 |
18.反应aA (g)+bB (g)?cC(g)建立的平衡体系如图表示,则下列说法正确的是( )
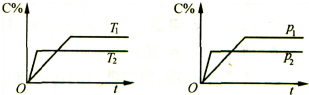

| A. | Tl>T2,△H<O | B. | Tl<T2,△H<O | C. | Pl>P2,a+b>c | D. | Pl<P2,a+b>c |
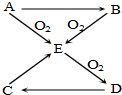 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.