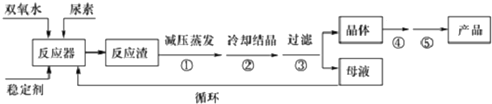
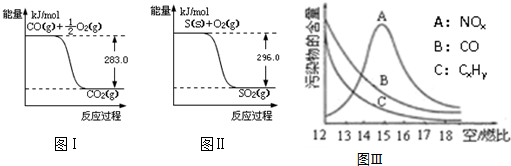
题目内容
14.一定条件下,在体积为5L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图1所示.已知达平衡后,降低温度,A的体积百分含量将减小.
(1)根据图1数据,写出反应的化学方程式A+2B?2C;
(2)此反应平衡常数的表达式为K=$\frac{{c}^{2}(C)}{c(A).{c}^{2}(B)}$.
(3)该反应的反应速率v和时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是升高温度.
②A的转化率最大的一段时间是t2~t3.
③各阶段的平衡常数如表所示:
| t2~t3 | t4~t5 | t5~t6 |
| K1 | K2 | K3 |
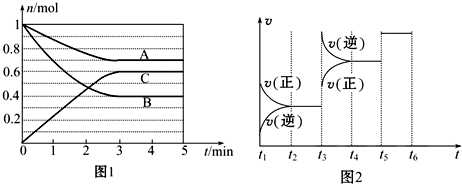
分析 (1)根据图1知,随着反应的进行,A、B的物质的量都减小而C的物质的量增大,则A和B是反应物而Z是生成物,达到平衡状态时△n(A)=(1-0.7)mol=0.3mol、△n(B)=(1-0.4)mol=0.6mol、△n(C)=(0.6-0)mol=0.6mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量之比等于其计量数之比,据此书写方程式;
(2)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(3)①降低温度A的百分含量减小,说明平衡逆向移动,则正反应是吸热反应,该反应的正反应是一个反应前后气体体积减小的吸热反应,在t3时刻改变条件时正逆反应速率都增大,且平衡逆向移动;
②t1~t2时平衡正向移动,t2~t3时反应达到平衡状态,t3~t4时平衡逆向移动;
③该反应的正反应是吸热反应,升高温度化学平衡常数增大,所以温度越高化学平衡常数越大.
解答 解:(1)根据图1知,随着反应的进行,A、B的物质的量都减小而C的物质的量增大,则A和B是反应物而Z是生成物,达到平衡状态时△n(A)=(1-0.7)mol=0.3mol、△n(B)=(1-0.4)mol=0.6mol、△n(C)=(0.6-0)mol=0.6mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量之比等于其计量数之比,A、B、C的计量数之比=0.3mol:0.6mol:0.6mol=1:2:2,所以化学方程式为A+2B?2C,
故答案为:A+2B?2C;
(2)化学平衡常数K=$\frac{{c}^{2}(C)}{c(A).{c}^{2}(B)}$,
故答案为:$\frac{{c}^{2}(C)}{c(A).{c}^{2}(B)}$;
(3)①降低温度A的百分含量减小,说明平衡逆向移动,则正反应是吸热反应,该反应的正反应是一个反应前后气体体积减小的吸热反应,在t3时刻改变条件时正逆反应速率都增大,且平衡逆向移动,改变的条件是升高温度,故答案为:升高温度;
②t1~t2时平衡正向移动,t2~t3时反应达到平衡状态,t3~t4时平衡逆向移动,所以A的转化率最大的是t2~t3,
故答案为:t2~t3;
③t3时刻改变的条件是升高温度,t5改变的条件是加入催化剂,该反应的正反应是吸热反应,升高温度化学平衡常数增大,所以温度越高化学平衡常数越大,所以化学平衡常数大小顺序是K1>K2=K3,
故答案为:K1>K2=K3.
点评 本题考查化学平衡常数计算及外界条件对化学平衡影响,侧重考查学生分析计算能力,化学平衡常数只与温度有关,与物质转化率及物质浓度都无关,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 托盘两边各垫一张质量相等的纸片称取固体NaOH | |
| B. | 容量瓶内水分未干便注入了液体 | |
| C. | 洗涤刚才盛过溶质的烧杯的洗涤液没有转入容量瓶 | |
| D. | 定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴加蒸馏水至刻度线 |
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1(填“>”、“<”或“=”).
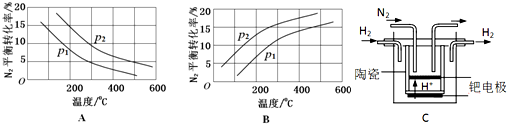
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
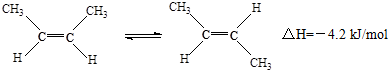
| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热比反-2-丁烯大 | |
| C. | 加压和降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 它们与氢气加成反应后的产物具有不同的沸点 |
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2)该反应的正反应为放热反应(“吸热”或“放热”);原因是升高温度平衡常数减小,平衡逆向移动
(3)能判断该反应是否已经达到化学平衡状态的是:D
A.混合气体总的物质的量不变 B.容器中压强不变
C.混合体系中平均摩尔质量不变 D.混合气体中CO浓度不变
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
①前2min,CO2的平均反应速率;
②3min-4min达到平衡时CO的平衡浓度c3(c3精确到小数点后面三位数).