题目内容
15.铝和铁是生活中非常常见的金属,运用所学知识回答:(1)金属铝是活泼的金属,但在生活中的应用仍很广泛,原因是铝表面容易生成一层致密的氧化物保护膜,对内部的金属起到了保护作用.
(2)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示)2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(3)写出还原铁粉与水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
分析 (1)铝易被氧化,表面易形成致密的氧化膜;
(2)根据铝可以和氢氧化钠及水反应生成偏铝酸钠和氢气,气体压强增大;
(3)铁粉和水蒸气在高温条件下发生氧化还原反应生成四氧化三铁和氢气.
解答 解:(1)铝是一种比较活泼的金属,在常温下就很容易跟氧气发生反应,生成一层致密而坚固的氧化铝薄膜,
故答案为:铝表面容易生成一层致密的氧化物保护膜,对内部的金属起到了保护作用;
(2)根据铝可以和氢氧化钠及水反应生成偏铝酸钠和氢气,其化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,气体压强增大,易拉罐会慢慢复原,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)铁粉和水蒸气在高温条件下发生氧化还原反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题主要考查了铝的性质及其化学方程式的书写,涉及氧化还原反应,根据反应物、生成物及反应条件书写方程式即可,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq),下列说法正确的是( )
| A. | MnS的Ksp比CuS的Ksp小 | |
| B. | 该反应达平衡时c(Mn2+)=c(Cu2+) | |
| C. | 设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS) | |
| D. | 往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大 |
6.物质结构理论推出:金属晶体中金属阳离子与自由电子之间的强烈的相互作用,叫金属键.金属键越强,其金属的硬度越大,熔、沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强.由此判断下列说法错误的是( )
| A. | 镁的硬度小于铝 | B. | 镁的熔、沸点低于钙 | ||
| C. | 镁的硬度大于钾 | D. | 钙的熔、沸点高于钾 |
3.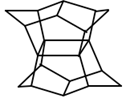 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )| A. | 分子式为C20H24 | B. | 一氯代物的同分异构体只有两种 | ||
| C. | 分子中含有4个亚甲基(-CH2-) | D. | 分子中含有4个五元碳环 |
10.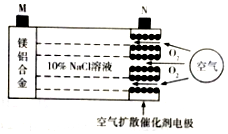 中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
 中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )| A. | 电池工作时,负极附近溶液的pH升高 | |
| B. | 电池工作时,电流由M极经外电路流向N极 | |
| C. | 电路中转移2mol电子,理论上约消耗标准状况下空气56L | |
| D. | 电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO |
20.下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是( )
| A. | CH3CH2CH3 | B. | CH3CH(CH3)CH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
7.将30mL0.5mol/L的NaOH溶液加水稀释到500mL,所得溶液的物质的量浓度为( )
| A. | 0.05mol/L | B. | 0.03mol/L | C. | 0.3mol/L | D. | 0.04mol/L |
4.下列仪器垫石棉网加热的是( )
| A. | 燃烧匙 | B. | 烧杯 | C. | 量筒 | D. | 试管 |
14.一定条件下,在体积为5L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图1所示.
已知达平衡后,降低温度,A的体积百分含量将减小.
(1)根据图1数据,写出反应的化学方程式A+2B?2C;
(2)此反应平衡常数的表达式为K=$\frac{{c}^{2}(C)}{c(A).{c}^{2}(B)}$.
(3)该反应的反应速率v和时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是升高温度.
②A的转化率最大的一段时间是t2~t3.
③各阶段的平衡常数如表所示:
则K1、K2、K3之间的关系为:K1>K2=K3(选用“>”、“<”或“=”连接).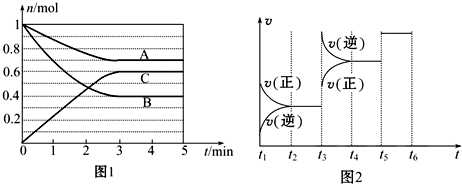
已知达平衡后,降低温度,A的体积百分含量将减小.
(1)根据图1数据,写出反应的化学方程式A+2B?2C;
(2)此反应平衡常数的表达式为K=$\frac{{c}^{2}(C)}{c(A).{c}^{2}(B)}$.
(3)该反应的反应速率v和时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是升高温度.
②A的转化率最大的一段时间是t2~t3.
③各阶段的平衡常数如表所示:
| t2~t3 | t4~t5 | t5~t6 |
| K1 | K2 | K3 |
