题目内容
12.现有部分短周期元素的性质与原子(或分子)结构如表:| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的 3 倍 |
| X | 常温下单质为双原子分子,分子中含有 3 对共用电子对 |
| Y | M 层比 K 层少 1 个电子 |
| Z | 第 3 周期元素的简单离子中半径最小 |
(2)元素 Y 与元素 Z 相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是CD(填序号).
A.Y 单质的熔点比 Z 单质低 B.Y 的化合价比 Z 低
C.Y 单质与水反应比 Z 单质剧烈 D.Y 最高价氧化物的水化物的碱性比 Z 强
(3)X 元素的气态氢化物与其最高价含氧酸反应的离子方程式为NH3+H+=NH4+.
(4)元素 T 和氢元素以原子个数比 1:1 化合形成化合物 Q,元素 X 与氢元素以原子个数比 1:2 化合形成常用作火箭燃料的化合物 W,Q 与 W 发生氧化还原反应,生成 X 单质和 T 的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=4H2O+N2↑.
分析 短周期元素中,T原子元素最外层电子数是次外层电子数的 3 倍,由于最外层电子数不超过8,则T原子有2个电子层,最外层电子数为6,则T为O元素;常温下X元素单质为双原子分子,分子中含有 3 对共用电子对,则X为N元素;Y元素原子的M 层比 K 层少 1 个电子,则Y为Na;第3周期元素的简单离子中Z的离子半径最小,则Z为Al元素.
解答 解:短周期元素中,T原子元素最外层电子数是次外层电子数的 3 倍,由于最外层电子数不超过8,则T原子有2个电子层,最外层电子数为6,则T为O元素;常温下X元素单质为双原子分子,分子中含有 3 对共用电子对,则X为N元素;Y元素原子的M 层比 K 层少 1 个电子,则Y为Na;第3周期元素的简单离子中Z的离子半径最小,则Z为Al元素.
(1)T为O元素,原子结构示意图为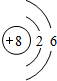 ,故答案为:
,故答案为: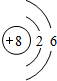 ;
;
(2)同周期自左而右金属性减弱,故Na的金属性比Al的强,
A.单质的熔点属于物理性质,不能比较金属性强弱,故A错误;
B.金属性强弱与失去电子难易程度有关,与失去电子数目无关,即与元素化合价无关,故B错误;
C.Na单质与水反应比 Al单质剧烈,说明Na的金属性更强,故C正确;
D.金属性越强,最高价氧化物对应水化物的碱性越强,Na最高价氧化物的水化物的碱性比 Al的强,说明钠的金属性更强,故D正确,
故答案为:Na;CD;
(3)氮元素的气态氢化物与其最高价含氧酸反应的离子方程式为:NH3+H+=NH4+,
故答案为:NH3+H+=NH4+;
(4)元素 T(氧) 和氢元素以原子个数比 1:1 化合形成化合物 Q为H2O2,元素 X(氮) 与氢元素以原子个数比 1:2 化合形成常用作火箭燃料的化合物 W为N2H4,二者 发生氧化还原反应,生成氮气和水,该反应的化学方程式为:2H2O2+N2H4=4H2O+N2↑,
故答案为:2H2O2+N2H4=4H2O+N2↑.
点评 本题考查位置结构与性质的关系,试题侧重于学生的分析能力的考查,正确推断各元素为解答关键,注意掌握金属性、非金属性强弱比较实验事实.

| A. | Na+的电子排布图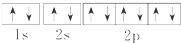 | B. | Na+的结构示意图: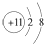 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化的电子排布式:[Na]3s1 |
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| W | 短周期内原子半径最大的元素 |
| N | 原子序数比T小,且与T在同一主族 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氨化物的水溶液呈碱性 |
| Z | 元素最高正价为+7价 |
(2)XN2的电子式是:
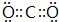 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式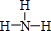 .
.(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(4)用电子式表示WZ的形成过程
 .
.(5)元素Z和T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是B.
A.常温下Z单质和T单质状态不同B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式2Na+2H2O=2NaOH+H2↑所得溶液的溶质是离子化合物(填“离子”或“共价”).
①X、Z、W三种元素可以形成橘红色易升华的固体配合物W2(XZ)8,该配合物中提供空轨道的是Co,提供孤对电子的是CO(填化学式).
②已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石.该化合物的化学式为C3N4,其晶体类型为原子晶体,晶体中X元素原子的杂化方式为sp3.简要分析该晶体比金刚石晶体硬度大的原因C-N键的键长小于C-C键,键能大于C-C键(金刚石的密度3.51g•cm-3,该晶体密度为3.6g•cm-3)
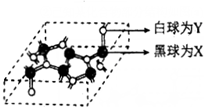 |  |
| 图(a) | 图(b) |
| A. | 该溶液中的溶质只有NH4Cl | |
| B. | 当溶液呈碱性时:c(NH4+)+c(H+)<c(Cl-)+c(OH-) | |
| C. | 溶液中离子浓度大小关系可能为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 该溶液可能由pH=12的氨水与pH=2的HCl溶液等体积混合而成 |
| A. | 0.1 mol-NH2中含有的电子数为0.7NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |