题目内容
7.X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y元素基态原子的2p轨道处于半充满状态;M为元素周期表1~36号元素中电负性最小的元素,W元素基态原子的价电子构型为3d74s2;R位于周期表第11列.回答下列问题(若需表示具体元素必须用相应的元素符号):①X、Z、W三种元素可以形成橘红色易升华的固体配合物W2(XZ)8,该配合物中提供空轨道的是Co,提供孤对电子的是CO(填化学式).
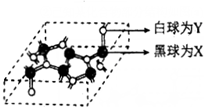
②已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石.该化合物的化学式为C3N4,其晶体类型为原子晶体,晶体中X元素原子的杂化方式为sp3.简要分析该晶体比金刚石晶体硬度大的原因C-N键的键长小于C-C键,键能大于C-C键(金刚石的密度3.51g•cm-3,该晶体密度为3.6g•cm-3)
 |  |
| 图(a) | 图(b) |
分析 X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,Y元素基态原子的2P轨道处于半充满状态,原子核外电子排布式为1s22s22p3,故Y为N元素;X、Y、Z是位于同一周期的相邻元素,结合原子序数可知X为C元素、Z为O元素;M为元素周期表1~36号元素中电负性最小的元素,则M为K;W元素基态原子的价电子构型为3d74s2,则W为Co;R位于周期表第11列,原子序数大于Co,故R为Cu.
①中心原子或离子含有空轨道,配体含有孤对电子;
②从给出的“化合物”的结构图可知,C原子形成4个键,N原子形成3个键,该化合物的化学式为C3N4,故其化学键为共价键,结合硬度大可知其为原子晶体,碳原子形成4个键,尽管N原子形成3个键,但还有1对孤对电子,价层电子对数都是4;原子晶体中共价键越短,化学键越稳定,硬度越大;
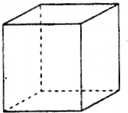
③R为Cu,晶体属于面心立方最密堆积,Cu原子处于顶点与面心,面对角线上的原子相切,Cu原子之间为a pm,则晶胞棱长=a×10-10 cm×2×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$a×10-10 cm,根据均摊法计算晶胞中Cu原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,Y元素基态原子的2P轨道处于半充满状态,原子核外电子排布式为1s22s22p3,故Y为N元素;X、Y、Z是位于同一周期的相邻元素,结合原子序数可知X为C元素、Z为O元素;M为元素周期表1~36号元素中电负性最小的元素,则M为K;W元素基态原子的价电子构型为3d74s2,则W为Co;R位于周期表第11列,原子序数大于Co,故R为Cu.
①X、Z、W三种元素可以形成橘红色易升华的固体配合物Co2(CO)8,该配合物中提供空轨道的是Co,提供孤对电子的是CO,
故答案为:Co;CO;
②从给出的“化合物”的结构图可知,C原子形成4个键,N原子形成3个键,该化合物的化学式为C3N4,故其化学键为共价键,结合硬度大可知其为原子晶体,碳原子形成4个键,故其为sp3杂化,尽管N原子形成3个键,但还有1对孤对电子,价层电子对数为4,因此N原子也是sp3杂化,
由于C-N键的键长小于C-C键,键能大于C-C键,则硬度超过金刚石,
故答案为:C3N4;原子晶体;sp3;C-N键的键长小于C-C键,键能大于C-C键;
③R为Cu,晶体属于面心立方最密堆积,Cu原子位置为 ,面对角线上的原子相切,Cu原子之间为a pm,则晶胞棱长=a×10-10 cm×2×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$a×10-10 cm,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cu的相对原子质量为M,则故晶胞质量为4×$\frac{M}{{N}_{A}}$g,则晶胞密度为4×$\frac{M}{{N}_{A}}$g÷($\sqrt{2}$a×10-10 cm)3=$\frac{\sqrt{2}M×1{0}^{30}}{{a}^{3}{N}_{A}}$g•cm-3,
,面对角线上的原子相切,Cu原子之间为a pm,则晶胞棱长=a×10-10 cm×2×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$a×10-10 cm,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cu的相对原子质量为M,则故晶胞质量为4×$\frac{M}{{N}_{A}}$g,则晶胞密度为4×$\frac{M}{{N}_{A}}$g÷($\sqrt{2}$a×10-10 cm)3=$\frac{\sqrt{2}M×1{0}^{30}}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为: ;$\frac{\sqrt{2}M×1{0}^{30}}{{a}^{3}{N}_{A}}$.
;$\frac{\sqrt{2}M×1{0}^{30}}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、元素周期律、配合物、晶体类型与性质、晶胞结构与计算等,掌握均摊法进行晶胞有关计算,是对学生综合能力的考查.

| A. | X、Z、Y、W的原子半径依次减小 | |
| B. | 若W与Y的原子序数相差5,则二者形成化合物的化学式可能为Y3W2 | |
| C. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| D. | W与X形成的化合物只含离子键 |
| A. | 室温下CH3COONa溶液的pH值大于7 | |
| B. | 同温同浓度的盐酸与CH3COOH溶液比较,醋酸溶液导电能力弱 | |
| C. | CH3COOH不与NaCl反应 | |
| D. | 室温下0.1 mol/L CH3COOH溶液的pH=2.9 |
| A. | 原子半径X>Y>Z | B. | 气态氢化物稳定性 HX>HZ>HY | ||
| C. | 非金属性X>Y>Z | D. | 气态氢化物还原性HX>HY>HZ |
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的 3 倍 |
| X | 常温下单质为双原子分子,分子中含有 3 对共用电子对 |
| Y | M 层比 K 层少 1 个电子 |
| Z | 第 3 周期元素的简单离子中半径最小 |
(2)元素 Y 与元素 Z 相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是CD(填序号).
A.Y 单质的熔点比 Z 单质低 B.Y 的化合价比 Z 低
C.Y 单质与水反应比 Z 单质剧烈 D.Y 最高价氧化物的水化物的碱性比 Z 强
(3)X 元素的气态氢化物与其最高价含氧酸反应的离子方程式为NH3+H+=NH4+.
(4)元素 T 和氢元素以原子个数比 1:1 化合形成化合物 Q,元素 X 与氢元素以原子个数比 1:2 化合形成常用作火箭燃料的化合物 W,Q 与 W 发生氧化还原反应,生成 X 单质和 T 的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=4H2O+N2↑.
| A. | 原子序数:E>D>B>C>A | B. | 原子半径:D>E>A>C>B | ||
| C. | 最简单氢化物的热稳定性:C>B>A | D. | 离子半径:C->D+>E3+>B2- |
| A. | 8g | B. | 10g | C. | 10.2g | D. | 11.2g |
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
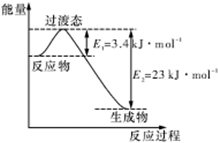
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃能量催化剂条件下转化生成甲醇蒸汽和水蒸气.如图表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据是bd(填字母).
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正)<v(逆)(填“<’’、“>”或“=’’).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.0l mol.L-l H2C2O4溶液中滴加10mL 0.01mol.L-l NaOH溶液时,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式
为CH3OCH3+16OH--12e-=2CO32-+11H2O.
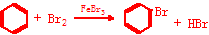 .
.