题目内容
4.用“石灰石一石膏”法进行烟气脱硫,是目前工业生产中常用的烟道脱硫方法,从石灰石转化为石膏可用下式表示:2CaCO 3+2SO2+O2→2CaSO4+2CO2.如果SO2的转化百分率为95%,要吸收10tSO2,生成CaSO4的质量是多少吨?
分析 SO2的转化百分率为95%,要吸收10tSO2,实际上转化的二氧化硫质量=10t×95%=9.5t,根据S原子守恒计算硫酸钙的质量.
解答 解:SO2的转化百分率为95%,要吸收10tSO2,实际上转化的二氧化硫质量=10t×95%=9.5t,根据S原子守恒得n(CaSO4)=n(SO2)=$\frac{9.5×1{0}^{6}g}{64g/mol}$,m(CaSO4)=n(SO2).M(CaSO4)=$\frac{9.5×1{0}^{6}g}{64g/mol}×136g/mol$=20.2×106g=20.2t,
答:SO2的转化百分率为95%,要吸收10tSO2,生成CaSO4的质量是20.2t.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确原子守恒内涵是解本题关键,注意单位之间的换算,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
14.现有部分短周期元素的性质、应用或原子结构如下表:
(1)元素X可测定文物年代的同位素符号是614C.
(2)元素Z在周期表中的位置为第三周期ⅦA族.Y单质的结构式为N≡N.
(3)元素Y与氢元素形成一种离子YH4+,实验室检验溶液中含有这种离子方法是:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层电子数的3倍 |
| X | 一种同位素可测定文物年代 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Z在周期表中的位置为第三周期ⅦA族.Y单质的结构式为N≡N.
(3)元素Y与氢元素形成一种离子YH4+,实验室检验溶液中含有这种离子方法是:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O(仅用离子反应方程式表示).
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强.
12.现有部分短周期元素的性质与原子(或分子)结构如表:
(1)写出元素 T 的原子结构示意图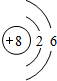
(2)元素 Y 与元素 Z 相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是CD(填序号).
A.Y 单质的熔点比 Z 单质低 B.Y 的化合价比 Z 低
C.Y 单质与水反应比 Z 单质剧烈 D.Y 最高价氧化物的水化物的碱性比 Z 强
(3)X 元素的气态氢化物与其最高价含氧酸反应的离子方程式为NH3+H+=NH4+.
(4)元素 T 和氢元素以原子个数比 1:1 化合形成化合物 Q,元素 X 与氢元素以原子个数比 1:2 化合形成常用作火箭燃料的化合物 W,Q 与 W 发生氧化还原反应,生成 X 单质和 T 的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=4H2O+N2↑.
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的 3 倍 |
| X | 常温下单质为双原子分子,分子中含有 3 对共用电子对 |
| Y | M 层比 K 层少 1 个电子 |
| Z | 第 3 周期元素的简单离子中半径最小 |
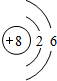
(2)元素 Y 与元素 Z 相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是CD(填序号).
A.Y 单质的熔点比 Z 单质低 B.Y 的化合价比 Z 低
C.Y 单质与水反应比 Z 单质剧烈 D.Y 最高价氧化物的水化物的碱性比 Z 强
(3)X 元素的气态氢化物与其最高价含氧酸反应的离子方程式为NH3+H+=NH4+.
(4)元素 T 和氢元素以原子个数比 1:1 化合形成化合物 Q,元素 X 与氢元素以原子个数比 1:2 化合形成常用作火箭燃料的化合物 W,Q 与 W 发生氧化还原反应,生成 X 单质和 T 的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=4H2O+N2↑.
19.A、B、C、D、E是短周期元素,A、B、C处于同一周期,A元素的原子最外层电子数是次外层的2倍,B2-、C-、D+、E3+具有相同电子层结构,下列说法正确的是( )
| A. | 原子序数:E>D>B>C>A | B. | 原子半径:D>E>A>C>B | ||
| C. | 最简单氢化物的热稳定性:C>B>A | D. | 离子半径:C->D+>E3+>B2- |
9.下列实验装置或实验操作能达到相应实验目的是( )
| A | B | C | D |
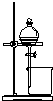 | 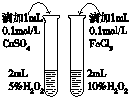 | 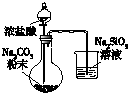 | 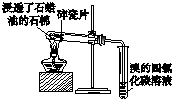 |
| 用于分离苯萃取碘水后的有机层和水层 | 比较不同种催化剂对反应速率的影响 | 验证酸性:H2CO3>H2SiO3 | 证明石蜡油分解生成的气体是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
16.将4.9g Mg和Fe的混合物在过量的稀硝酸中完全反应,得到标准状况下NO气体2.24L,向反应后的溶液中加入足量的烧碱充分反应,最后生成的沉淀的质量是( )
| A. | 8g | B. | 10g | C. | 10.2g | D. | 11.2g |
16.下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 | |
| B. | 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 | |
| C. | 将0.2 mol•L-1NaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)=c(HCO${\;}_{3}^{-}$)+c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
17.化学与工农业生产、人类生活密切相关.下列说法中不正确的是( )
| A. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| B. | 喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | “地沟油”经加工处理后,可用于生产肥皂和生物柴油 |
 .
.