题目内容
17.下列说法正确的是( )| A. | 常温下,向 0.1mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值减小到原来的$\frac{1}{10}$ | |
| B. | 常温时,将PH=1的醋酸和 PH=13的NaOH溶液等体积混合后的溶液:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下0.1mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 室温下,将0.4mol/LHA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c(OH- )>c(H+)+c(HA) |
分析 A.根据电离常数K=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$分析.
B.pH=1的醋酸溶液中醋酸的浓度大于0.1mol/L,pH=13的NaOH溶液浓度等于0.1mol/L,二者等体积混合,醋酸过量;
C.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解;
D.反应后溶质为等浓度的NaA和HA,测得混合液pH=5,说明HA的电离程度大于NaA的水解程度,则c(A-)>c(HA),根据物料守恒c(A-)+c(HA)=2c(Na+)可得:c(HA)<c(Na+),再结合电荷守恒进行判断.
解答 解:A.加水稀释,电离常数K=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$不变,当溶液的pH从3.0升到4.0时,c(H+)由10-3mol/L减小到10-4mol/L,则c(H+)减小到原来的$\frac{1}{10}$,由于酸性减弱,促进水的电离,水电离出氢离子浓度增大,所以酸电离的氢离子浓度小于原来的$\frac{1}{10}$,则溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值小于原来的$\frac{1}{10}$,故A错误;
B.pH=1的醋酸溶液中醋酸的浓度大于0.1mol/L,pH=13的NaOH溶液浓度等于0.1mol/L,二者等体积混合,醋酸过量,溶液显酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③NH3•H2O,④CH3COONH4,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解,则c(NH4+)由大到小的顺序是:①>②>④>③,故C错误;
D.室温下将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化),溶质为等浓度的NaA和HA,测得混合液pH=5,说明HA的电离程度大于NaA的水解程度,则c(A-)>c(HA),根据物料守恒c(A-)+c(HA)=2c(Na+)可得:c(HA)<c(Na+),结合电荷守恒c(A-)+c (OH-)=c(H+)+c(Na+)可得:c(A-)+c (OH-)>c(H+)+c(HA),故D正确;
故选D.
点评 本题考查了弱电解质的电离、盐的水解、离子浓度大小的比较,难度中等,熟悉酸的强弱与盐的水解的关系,电荷守恒、水解与电离的程度及相互影响是解答本题的关键,侧重于考查学生的分析能力.

| A. | R位于第四周期ⅥA族? | |
| B. | R最高价氧化物对应的水化物的化学式为H3RO4 | |
| C. | 元素R气态氢化物的化学式为H2R | |
| D. | R的阴离子具有强还原性 |
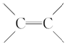 )不能自由旋转,因此
)不能自由旋转,因此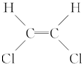 和
和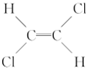 是两种不同的化合物,互为顺反异构体,则分子式为C4H7Cl的烯烃的异构体有( )
是两种不同的化合物,互为顺反异构体,则分子式为C4H7Cl的烯烃的异构体有( )| A. | 12种 | B. | 11种 | C. | 9种 | D. | 10种 |
| A. | 碳酸钙溶于稀盐酸中:Ca2++2H+=Ca2++H2O+CO2↑ | |
| B. | 向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 铜片跟稀硝酸反应:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O |
| A. | 115号元素可显+5价 | B. | X原子的中子数与电子数之差为174 | ||
| C. | 115号元素位于周期表第八周期 | D. | 115号元素属于非金属元素 |
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20分钟时间内A的平均速率为0.013mol/(L•min).
(2)在实验2,A的初始浓度c2=1.0mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1(填>、=、<)
(4)比较实验4和实验1,可推测该反应是吸热反应(选填吸热、放热).请简述理由温度升高时,平衡向右移动.
| A. | 各向异性 | B. | X-射线衍射 | ||
| C. | 导电性 | D. | 有规则的几何外形 |
 ,它含有的化学键类型有AC(填序号).
,它含有的化学键类型有AC(填序号). ”结构存在的同分异构体的数目有( )
”结构存在的同分异构体的数目有( )