题目内容
17.A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B、A与X均可形成10个电子化合物;B的最高价含氧酸可与其气态氢化物反应生成盐,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液先变红后褪色.用元素符号或化学式回答下列问题.
(1)X在周期表中的位置是第二周期第ⅥA族;
(2)化合物Y2X2的电子式为
 ,它含有的化学键类型有AC(填序号).
,它含有的化学键类型有AC(填序号).A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)X、Z的简单氢化物中沸点较高的是H2O(填化学式),原因是水分子间存在氢键.
(4)A与X和A与Z均能形成18个电子的化合物,这两种化合物发生反应可生成Z,其反应的化学方程式为:H2O2+H2S=S↓+2H2O;
(5)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为:H2-2e-+2OH-=2H2O.
分析 A、B、X、Y和Z是原子序数依次递增的短周期元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则Y2X2为Na2O2,X为O元素,Y为Na;X与Z同主族,则Z为S元素;B的最高价含氧酸可与其气态氢化物反应生成盐,则B为N元素;A与Y同主族,A与B、A与X均可形成10个电子化合物,则A为H元素.
解答 解:A、B、X、Y和Z是原子序数依次递增的短周期元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则Y2X2为Na2O2,X为O元素,Y为Na;X与Z同主族,则Z为S元素;B的最高价含氧酸可与其气态氢化物反应生成盐,则B为N元素;A与Y同主族,A与B、A与X均可形成10个电子化合物,则A为H元素.
(1)X为O元素,在周期表中的位置是:第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)化合物Na2O2的电子式为 ,含有离子键、非极性共价键,
,含有离子键、非极性共价键,
故答案为: ;AC;
;AC;
(3)水分子间存在氢键,沸点高于硫化氢,
故答案为:H2O;水分子间存在氢键;
(4)H与O和H与S均能形成18个电子的化合物,这两种化合物发生反应可生成S,应是H2O2、H2S反应生成硫与水,反应的化学方程式为:H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O;
(5)氢气、氧气制成新型的化学电源(KOH溶液作电解质溶液),负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2-2e-+2OH-=2H2O,
故答案为:H2-2e-+2OH-=2H2O.
点评 本题考查元素位置结构性质的关系、无机物推断、原电池等,侧重对化学用语的考查,推断元素是解题关键,熟练掌握元素化合物知识.

练习册系列答案
相关题目
8.人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代.以下说法正确的是( )
| A. | 原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动 | |
| B. | 目前我国广大农村生活做饭使用的都是氢能源 | |
| C. | 多能源时代指的是新能源时代,包括核能、太阳能、氢能 | |
| D. | 化石燃料的燃烧没有污染 |
5.下列叙述不正确的是( )
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 铵盐受热易分解,因此贮存氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 不能用稀HNO3和金属反应制取氢气 |
12.化学与生活、社会密切相关,下列说法不正确的是( )
| A. | 提倡人们购物时减少使用塑料袋,是为了减少白色污染 | |
| B. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 硫氧化物和碳氧化物是形成酸雨的主要物质 |
2. 常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )
常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )
 常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )
常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液PH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是( )| A. | a、b、c、d四个点中,水的电离程度最大的是d | |
| B. | a点溶液中:c(NH3•H2O)+c(H+)═c(OH-) | |
| C. | b点溶液中:c(Na+)+c(NH4+)═2c(SO42-) | |
| D. | c点溶液中:c(Na+)═c(SO42-)+c(NH4+)+c(NH3•H2O) |
9. 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
C(s)+2NO(g)?CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
| A. | 在T2时,若反应体系处于状态D,则此时v正>v逆 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB | |
| D. | 该反应的△H>0 |
17.下列说法正确的是( )
| A. | 常温下,向 0.1mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值减小到原来的$\frac{1}{10}$ | |
| B. | 常温时,将PH=1的醋酸和 PH=13的NaOH溶液等体积混合后的溶液:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下0.1mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 室温下,将0.4mol/LHA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c(OH- )>c(H+)+c(HA) |
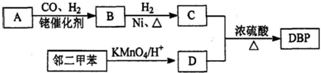

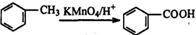


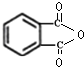 .
.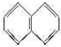 .
.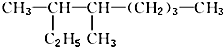 的名称是3,4一二甲基辛烷
的名称是3,4一二甲基辛烷