题目内容
9.某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度均为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20分钟时间内A的平均速率为0.013mol/(L•min).
(2)在实验2,A的初始浓度c2=1.0mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1(填>、=、<)
(4)比较实验4和实验1,可推测该反应是吸热反应(选填吸热、放热).请简述理由温度升高时,平衡向右移动.
分析 (1)结合v=$\frac{△c}{△t}$计算;
(2)B、D起始浓度均为0,且实验1、2的平衡浓度相同,则A的初始浓度相同;且实验2的反应速率快;
(3)1、3比较,平衡浓度3大,可知3中初始浓度大;
(4)实验4和实验1,温度不同,由数据可知,温度越高,A的平衡浓度越小.
解答 解:(1)在实验1,反应在10至20分钟时间内A的平均速率为v=$\frac{△c}{△t}$=$\frac{0.8mol/L-0.67mol/L}{10min}$=0.013mol/(L•min),故答案为:0.013;
(2)B、D起始浓度均为0,且实验1、2的平衡浓度相同,则A的初始浓度为1.0mol/L;且实验2的反应速率快,则可能使用了催化剂,
故答案为:1.0;催化剂;
(3)1、3比较,平衡浓度3大,可知3中初始浓度大,则3中反应速率大,即v3>v1,故答案为:>;
(4)实验4和实验1,温度不同,由数据可知,温度越高,A的平衡浓度越小,即温度升高时,平衡向右移动,则该反应为吸热反应,
故答案为:吸热;温度升高时,平衡向右移动.
点评 本题考查化学反应速率的影响因素,为高频考点,把握表格中的数据分析、浓度和温度对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意实验中变量控制,题目难度不大.

练习册系列答案
相关题目
8.人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代.以下说法正确的是( )
| A. | 原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动 | |
| B. | 目前我国广大农村生活做饭使用的都是氢能源 | |
| C. | 多能源时代指的是新能源时代,包括核能、太阳能、氢能 | |
| D. | 化石燃料的燃烧没有污染 |
9. 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
C(s)+2NO(g)?CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
| A. | 在T2时,若反应体系处于状态D,则此时v正>v逆 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB | |
| D. | 该反应的△H>0 |
17.下列说法正确的是( )
| A. | 常温下,向 0.1mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值减小到原来的$\frac{1}{10}$ | |
| B. | 常温时,将PH=1的醋酸和 PH=13的NaOH溶液等体积混合后的溶液:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下0.1mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 室温下,将0.4mol/LHA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c(OH- )>c(H+)+c(HA) |
4.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,X的气态氢化物可与其最高价含氧酸反应生成盐,由此可知( )
| W | X | |
| Y | Z |
| A. | Z元素氧化物对应水化物的酸性一定强于Y | |
| B. | X、Y、W中最简单氢化物稳定性最强的是X | |
| C. | 四种元素至少有一种为金属元素 | |
| D. | 最简单氢化物的沸点:X<Y |
1.下列反应后只可能生成一种有机物的是( )
| A. | CH3-CH=CH2与HCl加成 | |
| B. | CH3-CH2-CHOH-CH3消去反应 | |
| C. | C6H5-CH3在铁粉存在下与氯气反应 | |
| D. | CH3-CHOH-CH3在浓硫酸存在下,发生分子内脱水 |
19.下列有关合金的说法正确的是( )
| A. | 合金不能导电、传热 | B. | 合金没有延展性 | ||
| C. | 合金属于化合物 | D. | 合金的许多性能与其组成成分不同 |


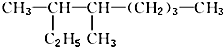 的名称是3,4一二甲基辛烷
的名称是3,4一二甲基辛烷