题目内容
7.某含碳、氢、氧三种元素的有机物的蒸气密度是相同条件下CO2的2倍,含氧量为36.4%.该有机物中氧原子只以“ ”结构存在的同分异构体的数目有( )
”结构存在的同分异构体的数目有( )| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
分析 密度之比等于相对分子质量之比,据此计算该有机物的相对分子质量;结合含有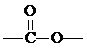
解答 解:该有机物相对分子质量为44×2=88,
(1)若该有机物为羧基,只有2种:正丁酸和异丁酸;
(2)若该有机物为酯,则有4种:甲酸正丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯,共6种,故选C.
点评 本题主要考查的是有机物分子式的计算以及同分异构体的判断,掌握丙基有2种是解决本题的关键,难度不大.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | 常温下,向 0.1mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值减小到原来的$\frac{1}{10}$ | |
| B. | 常温时,将PH=1的醋酸和 PH=13的NaOH溶液等体积混合后的溶液:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下0.1mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 室温下,将0.4mol/LHA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c(OH- )>c(H+)+c(HA) |
15.已知:常温下浓度为0.1mol/L的下列溶液的pH如表:
下列有关说法正确的是( )
| 溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
| pH | 7.5 | 11.6 | 9.7 | 8.3 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 等体积等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后 | |
| C. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)═0.1mol/L | |
| D. | 向Na2CO3溶液中通入少量的HF气体,化学反应方程式为:Na2CO3+2HF═CO2+H2O+2NaF |
2.准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol•L-1NaOH溶液滴定,测HCl溶液的浓度,下列说法正确的是( )
| A. | 滴定前滴定管尖嘴有气泡,终点读数时无气泡,则测定结果偏大 | |
| B. | 滴定管用蒸馏水洗涤后,直接装入NaOH溶液进行滴定 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由粉红色变无色时停止滴定 | |
| D. | 滴定时两眼应注视滴定管中液面的变化 |
12.室温时,将同种规格的铝片分别投入下列物质中,生成氢气的反应速率最大的是( )
| A. | 0.1mol/L盐酸15mL | B. | 0.2mol/L盐酸12mL | ||
| C. | 0.15mol/L硫酸8mL | D. | 浓硫酸15mL |
19.下列有关合金的说法正确的是( )
| A. | 合金不能导电、传热 | B. | 合金没有延展性 | ||
| C. | 合金属于化合物 | D. | 合金的许多性能与其组成成分不同 |
16.下列叙述正确的是( )
| A. | 电解质能导电,金属也能导电,所以金属都应该是电解质 | |
| B. | 无水硫酸铜不能导电,硫酸铜晶体(胆矾)中含有水,所以胆矾能导电 | |
| C. | 非电解质不能电离,电解质在一定条件下发生电离产生自由移动离子,从而能导电 | |
| D. | 氯化钠在电流作用下,电离生成自由移动离子 |
17.若 是某烃(分子式为C10H20)与H2加成后的产物,则该烃的结构可能有( )
是某烃(分子式为C10H20)与H2加成后的产物,则该烃的结构可能有( )
 是某烃(分子式为C10H20)与H2加成后的产物,则该烃的结构可能有( )
是某烃(分子式为C10H20)与H2加成后的产物,则该烃的结构可能有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 的名称是3,4一二甲基辛烷
的名称是3,4一二甲基辛烷