题目内容
9.已知 ,下列叙述错误的是( )
,下列叙述错误的是( )| A. | 反应①和②互为可逆反应 | |
| B. | 反应①中I2既作氧化剂又作还原剂 | |
| C. | 反应②中IO3-作氧化剂 | |
| D. | 检验加碘盐中的KIO3可用淀粉KI溶液和食醋 |
分析 反应①中氯气自身发生氧化还原反应生成I-和IO3-,酸性条件下I-和IO3-发生氧化还原反应生成碘,以此解答该题.
解答 解:A.反应①和②反应条件不同,不是可逆反应,故A错误;
B.反应①中I2生成I-和IO3-,I元素化合价既升高又降低,氯气既作氧化剂又作还原剂,故B正确;
C.反应②中IO3-生成氯气,I元素化合价降低,IO3-作氧化剂,故C正确;
D.由题给信息可知,酸性条件下发生IO3-+5I-+6H+=3I2↑+3H2O,可鉴别,故D正确.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列有关离子浓度的关系不正确的是( )
| A. | 常温下,NaA溶液的pH=8,则c(Na+)-c(A-)=9.9×10-7 | |
| B. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>(CH3COO-) | |
| C. | 0.1mol•L-1的NaHSO3的溶液中C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-) | |
| D. | 浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
17.下列化学用语能正确表示相应意义的是( )
| A. | 乙烯的结构简式C2H4 | B. | 丁烷的结构简式CH3(CH2)2CH3 | ||
| C. | 四氯化碳的电子式 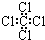 | D. | 环己烷的键线式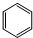 |
4.在隔绝空气的情况下,9.2g铁、镁、铝混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到4.48L(标准状况下)NO气体.在反应后的溶液中加入足量的烧碱溶液,可生成可生成氢氧化物的质量为( )
| A. | 18.6g | B. | 20g | C. | 19.4g | D. | 24g |
14.下列递变规律不正确的是( )
| A. | Na Mg Al还原性依次减弱 | B. | I2 Br2 Cl2氧化性依次增强 | ||
| C. | C N O 原子半径依次增大 | D. | P S Cl 最高正价依次升高 |
1.2014年12月科学家发现了迄今为止最轻的冰--“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构.下列有关叙述中不正确的是( )
| A. | “冰十六”的密度比液态水小 | B. | “冰十六”与干冰由不同分子构成 | ||
| C. | “冰十六”可以包合气体分子 | D. | 液态水转变成“冰十六”是化学变化 |
18.下列表述正确的是( )
| A. | c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl-不能大量共存 | |
| B. | 通入过量SO2气体的溶液中:HSO3-、NO3-、Ba2+不能大量共存 | |
| C. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液的离子方程式为:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| D. | 向Fe(NO3)3溶液中加入HI溶液的离子方程式为:2Fe3++2I-═2Fe2++2I2 |
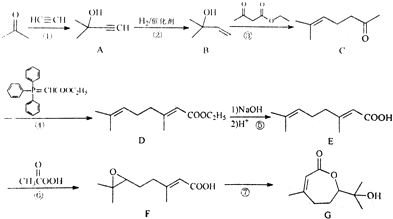
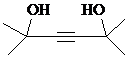 .
.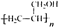 ,写出合成流程图(无机试剂任用).合成流程图示例如下:
,写出合成流程图(无机试剂任用).合成流程图示例如下: .
.