题目内容
1.2014年12月科学家发现了迄今为止最轻的冰--“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构.下列有关叙述中不正确的是( )| A. | “冰十六”的密度比液态水小 | B. | “冰十六”与干冰由不同分子构成 | ||
| C. | “冰十六”可以包合气体分子 | D. | 液态水转变成“冰十六”是化学变化 |
分析 A.冰中存在氢键,具有方向性和饱和性,其体积变大;
B.冰的成分为水,干冰成分为二氧化碳;
C.“冰十六”具有笼子一样的结构;
D.液态水转变成“冰十六”分子没有变化.
解答 解:A.冰中存在氢键,具有方向性和饱和性,其体积变大,则相同质量时冰的密度比液态水的密度小,故A正确;
B.冰的成分为水,干冰成分为二氧化碳,则冰与干冰由不同分子构成,故B正确;
C.“冰十六”具有笼子一样的结构,可以困住其他分子,所以“冰十六”可以包合气体分子,故C正确;
D.液态水转变成“冰十六”分子没有变化,分子的结合方式不同,属于物理变化,故D错误.
故选D.
点评 本题考查了分子结构与性质,题目难度不大,侧重于基础知识的考查,注意把握题中的信息.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.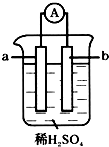 已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
 已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )| A. | 碳棒上有气体放出,溶液酸性变弱 | B. | a是正极,b是负极 | ||
| C. | 导线中有电子从a极到b极 | D. | a极上发生了氧化反应 |
12. 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示.则12g石墨烯中含有0.5NA个6元环.
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是增大压强、选用合适的催化剂;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(3)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如下表:
2当反应进行到30min时恰好到达平衡,则n2取值的最小范围是0.22<n<0.26;
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示.则12g石墨烯中含有0.5NA个6元环.
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是增大压强、选用合适的催化剂;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(3)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如下表:
| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
9.已知 ,下列叙述错误的是( )
,下列叙述错误的是( )
 ,下列叙述错误的是( )
,下列叙述错误的是( )| A. | 反应①和②互为可逆反应 | |
| B. | 反应①中I2既作氧化剂又作还原剂 | |
| C. | 反应②中IO3-作氧化剂 | |
| D. | 检验加碘盐中的KIO3可用淀粉KI溶液和食醋 |
16.下列离子方程式正确的是( )
| A. | 鸡蛋壳浸泡在盐酸中产生气泡:CO32-+2H+═CO2↑+H2O | |
| B. | 将氨气通入硫酸溶液中:NH3+H+═NH4+ | |
| C. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 向碳酸氢铵溶液中加入足量的NaOH溶液:NH4++OH-═NH3•H2O |
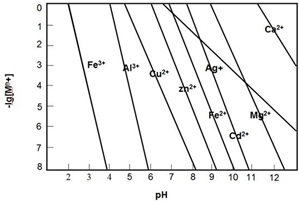
10.常温下,下列各组离子,在所给条件下能够大量共存的是( )
| A. | pH=0的溶液中,Fe3+、Mg2+、Cl-、SO42- | |
| B. | 水电离出的c(H+)=1×10-10的溶液中,K+、HCO3-、Na+、S2- | |
| C. | 使pH试纸显深蓝色的溶液中,Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在AlCl3溶液中:Na+、SO42-、NH4+、NO3- |
 甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物.试回答下列问题:
甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物.试回答下列问题: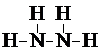 .
.
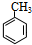 +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$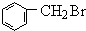 +HBr
+HBr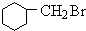 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$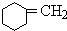 +NaBr+H2O
+NaBr+H2O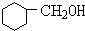 +NaBr.
+NaBr.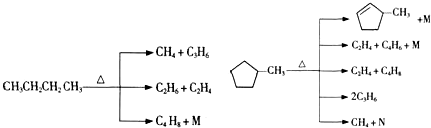
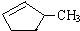 的说法正确的是A.
的说法正确的是A.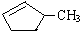 和
和
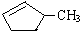 和
和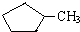 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同 可与水以任意比互溶
可与水以任意比互溶