题目内容
4.在隔绝空气的情况下,9.2g铁、镁、铝混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到4.48L(标准状况下)NO气体.在反应后的溶液中加入足量的烧碱溶液,可生成可生成氢氧化物的质量为( )| A. | 18.6g | B. | 20g | C. | 19.4g | D. | 24g |
分析 根据n=$\frac{V}{{V}_{m}}$计算出反应生成NO的物质的量,然后根据硝酸与金属反应生成一氧化氮中化合价变化计算出转移电子的物质的量;
金属在反应中的转化关系为:M→Mn+→M(OH)n,再结合电子守恒可知,金属失去电子的物质的量等于硝酸中N原子得到电子的物质的量,也等于生成沉淀时结合OH-的物质的量,据此可以计算出最多生成沉淀的质量=金属质量+净增OH-的质量,由于沉淀中没有氢氧化铝,所以生成沉淀的质量小于该沉淀的最大值.
解答 解:硝酸与金属反应生成一氧化氮:HNO3→NO,化合价降低3价,得到3e-电子,标况下4.48LNO的物质的量为:n(NO)=$\frac{4.48L}{22.4L/mol}$=0.2mol,得到电子的物质的量为:n(e-)=3e-×0.2mol=0.6mol,
根据金属的转化关系:M→Mn+→M(OH)n和电子守恒可知,金属失去电子的物质的量等于硝酸中N原子得到电子的物质的量,也等于生成沉淀时结合OH-的物质的量,即:n(OH-)=n(e-)=0.6mol,
则最多生成沉淀的质量为:金属质量+净增OH-的质量=9.2g+0.6mol×17g/mol=19.4g,
由于沉淀中没有氢氧化铝,所以生成沉淀的质量小于19.4g,
故选A.
点评 本题考查混合物的有关计算,题目难度中等,解题关键是正确判断金属提供的电子的物质的量与氢氧根的物质的量之间的关系,要求学生明确守恒思想运用方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列物质属于离子化合物的是( )
| A. | HCl | B. | NH3•H2O | C. | (NH4)2SO4 | D. | CH3COOH |
12. 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示.则12g石墨烯中含有0.5NA个6元环.
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是增大压强、选用合适的催化剂;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(3)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如下表:
2当反应进行到30min时恰好到达平衡,则n2取值的最小范围是0.22<n<0.26;
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示.则12g石墨烯中含有0.5NA个6元环.
(2)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol
①若要有利于甲醇的生成,除了改变温度外,还可以采取的两种措施是增大压强、选用合适的催化剂;
②甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(3)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如下表:
| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(4)用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
9.已知 ,下列叙述错误的是( )
,下列叙述错误的是( )
 ,下列叙述错误的是( )
,下列叙述错误的是( )| A. | 反应①和②互为可逆反应 | |
| B. | 反应①中I2既作氧化剂又作还原剂 | |
| C. | 反应②中IO3-作氧化剂 | |
| D. | 检验加碘盐中的KIO3可用淀粉KI溶液和食醋 |
16.下列离子方程式正确的是( )
| A. | 鸡蛋壳浸泡在盐酸中产生气泡:CO32-+2H+═CO2↑+H2O | |
| B. | 将氨气通入硫酸溶液中:NH3+H+═NH4+ | |
| C. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 向碳酸氢铵溶液中加入足量的NaOH溶液:NH4++OH-═NH3•H2O |
14.下列有关物质的性质或结构的说法正确的是( )
| A. | OH-中含有9个质子,9个电子 | |
| B. | Na的原子半径比Cl的大,但Na+的半径比Cl-的小 | |
| C. | 与某非金属反应时甲原子失电子数目比乙的多,说明甲的金属性比乙强 | |
| D. | Na2O 和Na2O2中所含的化学键类型完全相同 |
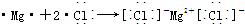 .
.

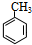 +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$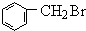 +HBr
+HBr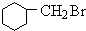 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$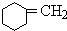 +NaBr+H2O
+NaBr+H2O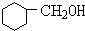 +NaBr.
+NaBr.