题目内容
19.按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;
B原子的3p轨道上得到一个电子后不能再容纳外来电子;
C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;
D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6.
(1)以下分别是哪种元素(用元素符号填空):
A:H; C:O;D:K;
(2)B原子的核外电子排布式1s22s22p63s23p5.
(3)E的原子结构示意图
 .
.
分析 A原子中只有一个电子层且只含1个电子,则A是H元素;
B原子3p轨道上得到1个电子后不能再容纳外来电子,则B是Cl元素;
C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反,则C是O元素;
D原子第三层上有8个电子,第四层上只有1个电子,则D是K元素;
E原子的外围电子排布为3s23p6,则E是Ar元素;再结合题目分析解答.
解答 解:(1)A原子中只有一个电子层且只含1个电子,则A是H元素;
B原子3p轨道上得到1个电子后不能再容纳外来电子,则B是Cl元素;
C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反,则C是O元素;
D原子第三层上有8个电子,第四层上只有1个电子,则D是K元素;
E原子的外围电子排布为3s23p6,则E是Ar元素,故答案为:H、O、K;
(2)B是Cl元素,原子的核外电子排布式为:1s22s22p63s23p5;故答案为:1s22s22p63s23p5;
(3)E是Ar元素,原子结构示意图为: ,故答案为:
,故答案为: .
.
点评 本题考查物质结构性质的相互关系及应用,涉及元素推断等知识点,侧重考查学生分析推断、知识运用能力.

练习册系列答案
相关题目
9.已知 ,下列叙述错误的是( )
,下列叙述错误的是( )
 ,下列叙述错误的是( )
,下列叙述错误的是( )| A. | 反应①和②互为可逆反应 | |
| B. | 反应①中I2既作氧化剂又作还原剂 | |
| C. | 反应②中IO3-作氧化剂 | |
| D. | 检验加碘盐中的KIO3可用淀粉KI溶液和食醋 |
10.常温下,下列各组离子,在所给条件下能够大量共存的是( )
| A. | pH=0的溶液中,Fe3+、Mg2+、Cl-、SO42- | |
| B. | 水电离出的c(H+)=1×10-10的溶液中,K+、HCO3-、Na+、S2- | |
| C. | 使pH试纸显深蓝色的溶液中,Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在AlCl3溶液中:Na+、SO42-、NH4+、NO3- |
7.下列有关碱金属元素铷(Rb)的叙述中,正确的是( )
| A. | 铷与水反应的现象跟钠相似 | |
| B. | 硝酸铷易溶于水 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷是弱碱 |
14.下列有关物质的性质或结构的说法正确的是( )
| A. | OH-中含有9个质子,9个电子 | |
| B. | Na的原子半径比Cl的大,但Na+的半径比Cl-的小 | |
| C. | 与某非金属反应时甲原子失电子数目比乙的多,说明甲的金属性比乙强 | |
| D. | Na2O 和Na2O2中所含的化学键类型完全相同 |
8.酯R在稀硫酸,加热的条件下可生成1molHOCH2CH2OH(乙二醇)和2mol羧酸(C5H10O2),则R的结构有( )
| A. | 6种 | B. | 10种 | C. | 12种 | D. | 14种 |
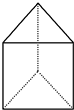 人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题.
人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题.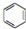 (Ⅱ)
(Ⅱ)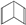
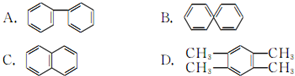
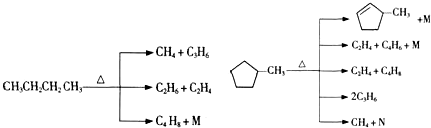
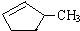 的说法正确的是A.
的说法正确的是A.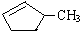 和
和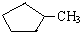
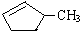 和
和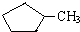 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同 可与水以任意比互溶
可与水以任意比互溶 .
.