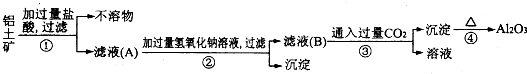
题目内容
某研究性学习小组设计实验制各乙酸乙酯(如图一):

(1)制各乙酸乙酯化学方程式为: .
(2)(2)实验过程中,用酒精灯缓慢加热,“缓慢加热”目的是 ;
(3)烧瓶B中加几块碎石片,其作用是 .长导管L的作用是 ;
(4)图一方案有明显缺陷,请提出改进建议: .经改进后,实验现象是 .简述分离乙酸乙酯的操作方法: ,需要用到如图二的仪器有 (填代号).

(1)制各乙酸乙酯化学方程式为:
(2)(2)实验过程中,用酒精灯缓慢加热,“缓慢加热”目的是
(3)烧瓶B中加几块碎石片,其作用是
(4)图一方案有明显缺陷,请提出改进建议:
考点:乙酸乙酯的制取
专题:实验题
分析:(1)乙酸与乙醇在浓硫酸作用下加热反应生成乙酸乙酯和水,据此写出反应的化学方程式;
(2)反应物乙酸好乙醇的沸点较低,温度较高二者容易挥发,导致转化率降低;
(3)乙酸和乙醇的混合液体在加热时容易发生暴沸,可以加入碎瓷片防止暴沸;长导管L起到了导气、冷凝的作用;
(4)乙酸乙酯在水中溶解度较大,应该用饱和碳酸钠溶液吸收乙酸乙酯;根据乙酸乙酯的物理性质进行分析观察到的现象;根据分液操作方法简述分离乙酸乙酯的操作方法;根据分液操作方法选择使用的仪器.
(2)反应物乙酸好乙醇的沸点较低,温度较高二者容易挥发,导致转化率降低;
(3)乙酸和乙醇的混合液体在加热时容易发生暴沸,可以加入碎瓷片防止暴沸;长导管L起到了导气、冷凝的作用;
(4)乙酸乙酯在水中溶解度较大,应该用饱和碳酸钠溶液吸收乙酸乙酯;根据乙酸乙酯的物理性质进行分析观察到的现象;根据分液操作方法简述分离乙酸乙酯的操作方法;根据分液操作方法选择使用的仪器.
解答:
解:(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+C2H5OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(2)乙酸和乙醇的沸点较低,加热时容易挥发,为了减少乙酸和乙醇挥发、提高反应物的转化率,则应该用酒精灯缓慢加热,
故答案为:减少乙酸和乙醇挥发,提高反应物的转化率;
(3)给乙酸和乙醇的混合液体加热过程中容易发生暴沸现象,故小于加入碎瓷片防止暴沸;长导管除了导气作用外,还起到了冷凝反应乙酸乙酯的效果,
故答案为:防止暴沸;冷凝兼导气;
(4)吸收乙酸乙酯应该选用饱和碳酸钠溶液,所以应该吧C中水换成饱和碳酸钠溶液;可以观察到C烧杯中的液体分层,上层液体具有果香味、且呈油状;分离出乙酸乙酯的方法为分液,操作方法为:将C烧杯里液体混合物用玻璃棒引流注入分液漏斗里,静置、分层,打开分液漏斗活塞,将下层碳酸钠等无机层液体放入烧杯里,上层乙酸乙酯液体从上口倒出;分液操作用到的仪器有:分液漏斗、烧杯和玻璃棒,即:afg,
故答案为:C中水换成饱和碳酸钠溶液;C烧杯里液体分层,上层液体具有果香味、且呈油状;将C烧杯里液体混合物用玻璃棒引流注入分液漏斗里,静置、分层,打开分液漏斗活塞,将下层碳酸钠等无机层液体放入烧杯里,上层乙酸乙酯液体从上口倒出;afg.
 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;(2)乙酸和乙醇的沸点较低,加热时容易挥发,为了减少乙酸和乙醇挥发、提高反应物的转化率,则应该用酒精灯缓慢加热,
故答案为:减少乙酸和乙醇挥发,提高反应物的转化率;
(3)给乙酸和乙醇的混合液体加热过程中容易发生暴沸现象,故小于加入碎瓷片防止暴沸;长导管除了导气作用外,还起到了冷凝反应乙酸乙酯的效果,
故答案为:防止暴沸;冷凝兼导气;
(4)吸收乙酸乙酯应该选用饱和碳酸钠溶液,所以应该吧C中水换成饱和碳酸钠溶液;可以观察到C烧杯中的液体分层,上层液体具有果香味、且呈油状;分离出乙酸乙酯的方法为分液,操作方法为:将C烧杯里液体混合物用玻璃棒引流注入分液漏斗里,静置、分层,打开分液漏斗活塞,将下层碳酸钠等无机层液体放入烧杯里,上层乙酸乙酯液体从上口倒出;分液操作用到的仪器有:分液漏斗、烧杯和玻璃棒,即:afg,
故答案为:C中水换成饱和碳酸钠溶液;C烧杯里液体分层,上层液体具有果香味、且呈油状;将C烧杯里液体混合物用玻璃棒引流注入分液漏斗里,静置、分层,打开分液漏斗活塞,将下层碳酸钠等无机层液体放入烧杯里,上层乙酸乙酯液体从上口倒出;afg.
点评:本题考查了乙酸乙酯的制备、常见仪器的构造及使用方法,题目难度中等,注意掌握乙酸乙酯的反应原理及制备方法,明确常见化学仪器的构造及正确的使用方法.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,由x g NO2和y g N2O4组成的混合气体中原子总数为3NA,则x+y=46 |
| B、1 mol氯气参加氧化还原反应,一定得到NA 或2NA个电子 |
| C、1升0.1 mol?L-1 NaBr溶液中,HBr和Br-总和为0.1NA个 |
| D、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
下列有关物质的性质和应用均正确的是( )
| A、ClO2具有强氧化性,可用于自来水的杀菌消毒,优于氯气的高效安全性 |
| B、NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 |
| C、酒精能使蛋白质变性,医学上使用无水酒精来杀菌消毒 |
| D、Na2CO3能与盐酸反应,广泛用于治疗胃酸过多 |

 (-R、-R′表示氢原子或烃基)
(-R、-R′表示氢原子或烃基)
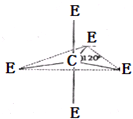 已知:A、B、C、D、E、M六种元素,原子序数依次增大.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同;B是短周期中原子半径最大的主族元素;C元素基态原子核外的3p能级半充满;E是所在周期中电负性最大的元素;M是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、M六种元素,原子序数依次增大.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同;B是短周期中原子半径最大的主族元素;C元素基态原子核外的3p能级半充满;E是所在周期中电负性最大的元素;M是第四周期未成对电子最多的元素.试回答下列有关的问题: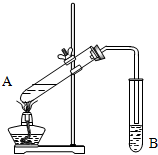 实验室用如图所示装置制取乙酸乙酯.
实验室用如图所示装置制取乙酸乙酯.