题目内容
某课外活动小组用铜屑制取五水合硫酸铜晶体.已知硫酸铜和硝酸铜的溶解度数据如下表:
(1)课外活动小组设计的实验步骤如下:
①用灼烧法除去铜屑表面的有机物和油污.灼烧时需要使用到的仪器有 .
A.烧杯 B.酒精灯 C.泥三角 D.蒸发皿 E.坩埚 F.漏斗
②将灼烧后的固体置于烧杯中,向其中加入一定量的硫酸,将烧杯放置在通风橱中加热,并向其中分批加入适量浓硝酸,直至反应结束,滤去少量不溶物.发生反应的化学方程式为: .
③将所得滤液用水浴加热蒸发浓缩,待看到 时,停止加热,冷却过滤得硫酸铜晶体.本操作采用水浴加热的原因 .
④除去硫酸铜晶体中含有的少量硝酸铜.可以用 法提纯硫酸铜晶体.
(2)该活动小组设计的制备硫酸铜晶体的实验方案,主要存在问题是消耗的酸多、产生的气体污染空气.请你重新设计一种经济、环保的实验方案: .
| T/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 硫酸铜/g | 14.8 | 20.5 | 28.5 | 39.6 | 53.6 | 73.0 |
| 硝酸铜/g | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 |
①用灼烧法除去铜屑表面的有机物和油污.灼烧时需要使用到的仪器有
A.烧杯 B.酒精灯 C.泥三角 D.蒸发皿 E.坩埚 F.漏斗
②将灼烧后的固体置于烧杯中,向其中加入一定量的硫酸,将烧杯放置在通风橱中加热,并向其中分批加入适量浓硝酸,直至反应结束,滤去少量不溶物.发生反应的化学方程式为:
③将所得滤液用水浴加热蒸发浓缩,待看到
④除去硫酸铜晶体中含有的少量硝酸铜.可以用
(2)该活动小组设计的制备硫酸铜晶体的实验方案,主要存在问题是消耗的酸多、产生的气体污染空气.请你重新设计一种经济、环保的实验方案:
考点:铜金属及其重要化合物的主要性质,制备实验方案的设计
专题:几种重要的金属及其化合物
分析:(1)①灼烧时将瓷坩埚置于泥三角上,用酒精灯进行加热;
②灼烧后的固体主要为铜,加入一定量的硫酸,不发生反应,当向其中分批加入适量浓硝酸时,溶液中有H+和NO3-,这时铜和H+和NO3-进行反应,直至铜反应结束;
③当晶膜出现时为饱和溶液,停止加热,冷却结晶能析出晶体,水浴加热能保持温度恒定,防止晶体分解;
④根据固体混合物中目标组分在某种溶剂中的溶解度随温度变化有明显差异,在较高温度下溶解度大,降低温度时溶解度小,从而用重结晶分离提纯;
(2)从安全、节约、环保等方面来设计,将铜屑在空气中灼烧氧化为CuO,再将CuO与硫酸反应,最后将所得溶液蒸发、结晶得CuSO4?5H2O,这样既没有产生污染气体,而且原料的利用率也高.
②灼烧后的固体主要为铜,加入一定量的硫酸,不发生反应,当向其中分批加入适量浓硝酸时,溶液中有H+和NO3-,这时铜和H+和NO3-进行反应,直至铜反应结束;
③当晶膜出现时为饱和溶液,停止加热,冷却结晶能析出晶体,水浴加热能保持温度恒定,防止晶体分解;
④根据固体混合物中目标组分在某种溶剂中的溶解度随温度变化有明显差异,在较高温度下溶解度大,降低温度时溶解度小,从而用重结晶分离提纯;
(2)从安全、节约、环保等方面来设计,将铜屑在空气中灼烧氧化为CuO,再将CuO与硫酸反应,最后将所得溶液蒸发、结晶得CuSO4?5H2O,这样既没有产生污染气体,而且原料的利用率也高.
解答:
解:(1)①用坩埚加热固体时应将坩埚放在泥三角上加热,用酒精灯进行加热,故答案为:BCE;
②灼烧后的固体主要为铜,加入一定量的硫酸,不发生反应,当向其中分批加入适量浓硝酸时,溶液中有H+和NO3-,这时铜和H+和NO3-进行反应,直至铜反应结束,故反应方程式为:Cu+2HNO3+H2SO4═CuSO4+2NO2↑+2H2O,故答案为:Cu+2HNO3+H2SO4═CuSO4+2NO2↑+2H2O;
③等晶膜出现时为饱和溶液,停止加热,冷却结晶能析出晶体,水浴加热能保持温度恒定,防止CuSO4?5H2O晶体分解,
故答案为:溶液表面有晶膜出现;控制温度,防止CuSO4?5H2O分解;
④因CuSO4?5H2O含有杂质Cu(NO3)2?xH2O,但Cu(NO3)2?xH2O溶解度随温度变化不大,故可用重结晶法提纯,故答案:重结晶;
(2)从安全、节约、环保等方面来设计,将铜屑在空气中灼烧氧化为CuO,再将CuO与硫酸反应,最后将所得溶液蒸发、结晶得CuSO4?5H2O,这样既没有产生污染气体,而且原料的利用率也高;故答案为:将铜屑在空气中灼烧氧化为CuO,再将CuO与硫酸反应,最后将所得溶液蒸发、结晶得CuSO4?5H2O.
②灼烧后的固体主要为铜,加入一定量的硫酸,不发生反应,当向其中分批加入适量浓硝酸时,溶液中有H+和NO3-,这时铜和H+和NO3-进行反应,直至铜反应结束,故反应方程式为:Cu+2HNO3+H2SO4═CuSO4+2NO2↑+2H2O,故答案为:Cu+2HNO3+H2SO4═CuSO4+2NO2↑+2H2O;
③等晶膜出现时为饱和溶液,停止加热,冷却结晶能析出晶体,水浴加热能保持温度恒定,防止CuSO4?5H2O晶体分解,
故答案为:溶液表面有晶膜出现;控制温度,防止CuSO4?5H2O分解;
④因CuSO4?5H2O含有杂质Cu(NO3)2?xH2O,但Cu(NO3)2?xH2O溶解度随温度变化不大,故可用重结晶法提纯,故答案:重结晶;
(2)从安全、节约、环保等方面来设计,将铜屑在空气中灼烧氧化为CuO,再将CuO与硫酸反应,最后将所得溶液蒸发、结晶得CuSO4?5H2O,这样既没有产生污染气体,而且原料的利用率也高;故答案为:将铜屑在空气中灼烧氧化为CuO,再将CuO与硫酸反应,最后将所得溶液蒸发、结晶得CuSO4?5H2O.
点评:本题考查制备实验方案的设计及物质的分离、提纯,明确实验目的,坚持绿色化学是解答的关键,结合物质的性质及反应原理即可解答,题目难度中等.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到0.8g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A、至少存在5种离子 |
| B、Cl-一定存在,且c(Cl-)≥0.1mol/L |
| C、SO42-、NH4+一定存在,Cl-可能不存在 |
| D、CO32-、Al3+一定不存在,K+可能存在 |
铜粉放入稀硫酸中,加热后无现象,当加入一点盐后,铜粉质量减少,新加入的盐可能是下列中的( )
| A、氯化物 | B、硫酸盐 |
| C、硝酸盐 | D、磷酸盐 |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS).由此可知下列分析正确的是( )
| A、原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| B、整个过程涉及的反应类型有氧化还原反应和复分解反应 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D、KSP(PbS)<Kap(CuS) |
在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3.铜粉可溶解的是( )
| A、①② | B、①④ | C、②③ | D、②④ |
 已知:( i)R1-CH=CH-R2
已知:( i)R1-CH=CH-R2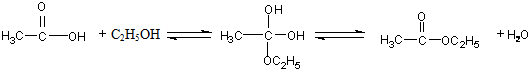
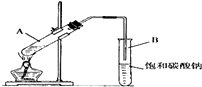 实验室用如图装置制取乙酸乙酯.
实验室用如图装置制取乙酸乙酯.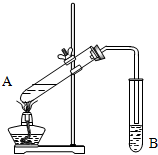 实验室用如图所示装置制取乙酸乙酯.
实验室用如图所示装置制取乙酸乙酯.