题目内容
用以下三种途径来制取相同质量的硝酸铜:
①铜与浓硝酸反应
②铜与稀硝酸反应
③铜与氧气反应生成CuO,CuO再与稀硝酸反应.
下列叙述中错误的是( )
①铜与浓硝酸反应
②铜与稀硝酸反应
③铜与氧气反应生成CuO,CuO再与稀硝酸反应.
下列叙述中错误的是( )
| A、消耗的硝酸的量:①>②>③ |
| B、铜与浓硝酸作用最快,故最佳方案是① |
| C、对环境造成的危害,③最小 |
| D、三种途径所消耗的铜的质量相等 |
考点:铜金属及其重要化合物的主要性质,硝酸的化学性质
专题:元素及其化合物
分析:制取硝酸铜有关反应为:①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;③2Cu+O2
2CuO,CuO+2HNO3(稀)=Cu(NO3)2+H2O从以上三组反应可以看出:生成相同质量的Cu(NO3)2,消耗相同质量的铜,但消耗硝酸的质量(或物质的量)不相同,途径①消耗HNO3最多,途径②次之,途径③消耗HNO3最少,通过比较可以看出,生产Cu(NO3)2,途径③效果最佳,既不造成污染,又能提高HNO3的利用率,据此即可解答.
| ||
解答:
解:方案中节约原料,则反应需步骤简单,消耗原料较少,为防止污染环境,应尽量少产生或不产生污染性气体.
①铜与浓硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,制备1molCu(NO3)2,需要2molHNO3,生成的2molNO2气体有毒,是污染性的气体;
②铜与稀硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,制备1molCu(NO3)2,需要
molHNO3,生成
mol有毒的NO气体;
③铜与氧气反应生成CuO,2Cu+O2
2CuO,氧化铜和硝酸反应生成硝酸铜和水,制备1molCu(NO3)2,需要2molHNO3,且没有生成污染性气体;
A.制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①需要2molHNO3,②需要
molHNO3,③需要2molHNO3,途径①消耗HNO3最多,途径②次之,途径③消耗HNO3最少,故A正确;
B.由方程式通过比较可以看出,生成相同质量的Cu(NO3)2,铜与浓硝酸反应速率最快,但消耗的硝酸最多,且造成较大污染,途径③效果最佳,既不造成污染,又能提高HNO3的利用率,故B错误;
C.制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①生成的2molNO2污染性的气体,②生成
mol有毒的NO气体,③没有生成污染性气体,故C正确;
D.制取相同质量的硝酸铜,制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①需要1molCu,②需要1molCu,③需要1molCu,所以所消耗的铜的质量相等,故D正确;
故选B.
①铜与浓硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,制备1molCu(NO3)2,需要2molHNO3,生成的2molNO2气体有毒,是污染性的气体;
②铜与稀硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,制备1molCu(NO3)2,需要
| 8 |
| 3 |
| 2 |
| 3 |
③铜与氧气反应生成CuO,2Cu+O2
| ||
A.制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①需要2molHNO3,②需要
| 8 |
| 3 |
B.由方程式通过比较可以看出,生成相同质量的Cu(NO3)2,铜与浓硝酸反应速率最快,但消耗的硝酸最多,且造成较大污染,途径③效果最佳,既不造成污染,又能提高HNO3的利用率,故B错误;
C.制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①生成的2molNO2污染性的气体,②生成
| 2 |
| 3 |
D.制取相同质量的硝酸铜,制备1molCu(NO3)2,生成相同质量的Cu(NO3)2,①需要1molCu,②需要1molCu,③需要1molCu,所以所消耗的铜的质量相等,故D正确;
故选B.
点评:本题考查硝酸铜的制备方案的评价,注意根据相关反应的化学方程式结合环保进行分析是解答的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 (-R、-R′表示氢原子或烃基)
(-R、-R′表示氢原子或烃基)
 →CH3-CHO+H2O
→CH3-CHO+H2O
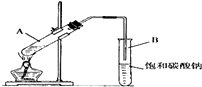 实验室用如图装置制取乙酸乙酯.
实验室用如图装置制取乙酸乙酯.
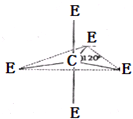 已知:A、B、C、D、E、M六种元素,原子序数依次增大.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同;B是短周期中原子半径最大的主族元素;C元素基态原子核外的3p能级半充满;E是所在周期中电负性最大的元素;M是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、M六种元素,原子序数依次增大.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同;B是短周期中原子半径最大的主族元素;C元素基态原子核外的3p能级半充满;E是所在周期中电负性最大的元素;M是第四周期未成对电子最多的元素.试回答下列有关的问题: