题目内容
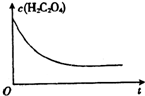 某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.
某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.(1)该反应的离子方程式为
(2)该实验中反应速率明显加快的原因可能是
A.反应放热导致温度升高 B.压强增大
C.生成物的催化作用 D.反应物接触面积增大
(3)为验证该反应速率明显加快的原因,甲同学继续进行了下列实验,请完成下表.
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色所需时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 4 | ||
| 3 | 60 | 25 |
考点:探究影响化学反应速率的因素,化学反应速率的影响因素
专题:化学反应速率专题
分析:(1)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,据此写出离子方程式;
(2)根据浓度、温度、催化剂对化学反应速率的影响分析;
(3)为验证该反应速率明显加快的原因,编号1和2的是研究催化剂对反应的影响,而编号2和3是研究温度对反应速率的影响,根据研究一种因素对反应速率的影响时保证其他条件一样的原则分析;
(4)催化剂只改变反应速率,不改变平衡移动.
(2)根据浓度、温度、催化剂对化学反应速率的影响分析;
(3)为验证该反应速率明显加快的原因,编号1和2的是研究催化剂对反应的影响,而编号2和3是研究温度对反应速率的影响,根据研究一种因素对反应速率的影响时保证其他条件一样的原则分析;
(4)催化剂只改变反应速率,不改变平衡移动.
解答:
解:(1)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)随着反应的进行,反应物浓度逐渐减小,化学反应速率减慢,因此不是浓度,反应放热导致温度升高,化学反应速率加快,催化剂可以加快化学反应速率,应为Mn2+对该反应起催化作用,故答案为:AC;
(3)为验证该反应速率明显加快的原因,编号1和2的是研究催化剂对反应的影响,则其余要保证一致,所以编号2数据分别为5.0、2.0,
而编号2和3是研究温度对反应速率的影响,则其余要保证一致,所以编号3数据分别为5.0、2.0,
故答案为:5.0;2.0;5.0;2.0;
(4)加入催化剂,反应速率加快,缩短了达到平衡的时间,但不改变平衡状态,加入催化剂时c(H2C2O4)~反应时间t的变化曲线示意图为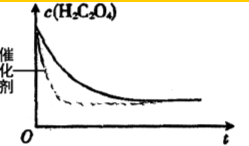 ,故答案为:
,故答案为: .
.
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)随着反应的进行,反应物浓度逐渐减小,化学反应速率减慢,因此不是浓度,反应放热导致温度升高,化学反应速率加快,催化剂可以加快化学反应速率,应为Mn2+对该反应起催化作用,故答案为:AC;
(3)为验证该反应速率明显加快的原因,编号1和2的是研究催化剂对反应的影响,则其余要保证一致,所以编号2数据分别为5.0、2.0,
而编号2和3是研究温度对反应速率的影响,则其余要保证一致,所以编号3数据分别为5.0、2.0,
故答案为:5.0;2.0;5.0;2.0;
(4)加入催化剂,反应速率加快,缩短了达到平衡的时间,但不改变平衡状态,加入催化剂时c(H2C2O4)~反应时间t的变化曲线示意图为
 ,故答案为:
,故答案为: .
.
点评:本题考查了外界条件的改变对化学反应速率的影响,题目难度较大,涉及对照试验等知识,注意催化剂只改变反应速率,不改变平衡移动.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关物质的性质和应用均正确的是( )
| A、ClO2具有强氧化性,可用于自来水的杀菌消毒,优于氯气的高效安全性 |
| B、NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 |
| C、酒精能使蛋白质变性,医学上使用无水酒精来杀菌消毒 |
| D、Na2CO3能与盐酸反应,广泛用于治疗胃酸过多 |
在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3.铜粉可溶解的是( )
| A、①② | B、①④ | C、②③ | D、②④ |
 在实验室我们也可以用如图所示的装置制取乙酸乙酯.
在实验室我们也可以用如图所示的装置制取乙酸乙酯.