题目内容
下列物质:①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
(1)属于电解质的是 ;(填序号)
(2)Ba(OH)2的电离方程式: ;
(3)写出NaHCO3溶液与NaOH溶液反应的离子方程式: ;
(4)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K1= .(已知:10-5.60=2.5×10-6)
(5)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液.
①该Ba(OH)2溶液的物质的量浓度为 ;
②溶液中由水电离出c(OH-)═ ;
③与某浓度HCl溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH= .
(1)属于电解质的是
(2)Ba(OH)2的电离方程式:
(3)写出NaHCO3溶液与NaOH溶液反应的离子方程式:
(4)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K1=
(5)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液.
①该Ba(OH)2溶液的物质的量浓度为
②溶液中由水电离出c(OH-)═
③与某浓度HCl溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=
考点:电解质与非电解质,离子方程式的书写,电离方程式的书写,化学平衡常数的含义,pH的简单计算,酸碱混合时的定性判断及有关ph的计算
专题:基本概念与基本理论
分析:(1)电解质是在水溶液中或熔融状态下能导电的化合物,根据定义判断;
(2)Ba(OH)2的是强电解质,在水溶液中完全电离出钡离子和氢氧根离子;
(3)NaHCO3溶液与NaOH溶液反应生成碳酸钠和水;
(4)碳酸为弱电解质,电离方程式为:H2CO3?HCO3-+H+的平衡常数K1=
;
(5)①Ba(OH)2是一种强电解质,完全电离,1molBa(OH)2电离产生2molOH-,所以C(OH-)=C(Ba(OH)2)×2,据此解答;
②pH=13的Ba(OH)2溶液中氢离子都是由水电离产生,水电离产生的c(H+)等于溶液中水电离出c(OH -);
③设盐酸的物质的量浓度为:C(HCl),碱与酸体积分别为1L、9L,分别求出氢氧化根离子和氢离子的物质的量,二者发生酸碱中和,所得溶液pH=11可知碱
剩余,求出剩余的氢氧根离子的物质的量,依据:Kw=c(H+)×c(OH -)计算解答;
(2)Ba(OH)2的是强电解质,在水溶液中完全电离出钡离子和氢氧根离子;
(3)NaHCO3溶液与NaOH溶液反应生成碳酸钠和水;
(4)碳酸为弱电解质,电离方程式为:H2CO3?HCO3-+H+的平衡常数K1=
| [HCO3-][H+] |
| [H2CO3] |
(5)①Ba(OH)2是一种强电解质,完全电离,1molBa(OH)2电离产生2molOH-,所以C(OH-)=C(Ba(OH)2)×2,据此解答;
②pH=13的Ba(OH)2溶液中氢离子都是由水电离产生,水电离产生的c(H+)等于溶液中水电离出c(OH -);
③设盐酸的物质的量浓度为:C(HCl),碱与酸体积分别为1L、9L,分别求出氢氧化根离子和氢离子的物质的量,二者发生酸碱中和,所得溶液pH=11可知碱
剩余,求出剩余的氢氧根离子的物质的量,依据:Kw=c(H+)×c(OH -)计算解答;
解答:
解:(1)③纯醋酸、④NaHCO3,在水溶液中能电离出自由移动的离子,是化合物,所以属于电解质;①Cu是单质,⑤Ba(OH)2溶液属于混合物,既不是
电解质也不是非电解质;②液态SO2 是化合物,但是本身不能电离出自由移动的离子,属于非电解质;
故选:③④;
(2)Ba(OH)2的电离方程式:Ba(OH)2=Ba 2++2OH-,
故答案为:Ba(OH)2=Ba 2++2OH-;
(3)NaHCO3溶液与NaOH溶液反应的离子方程式为:HCO3-+OH-=H2O+CO32-,
故答案为:HCO3-+OH-=H2O+CO32-;
(4)H2CO3?HCO3-+H+的平衡常数K1=
;溶液的pH=5.60,则:c(H+)=c(HCO3-)=2.5×10-6mol/L,c(H2CO3)=1.5×10-5mol?L-1.
带入平衡常数表达式得K1=4.16×10-7,
故答案为:4.16×10-7;
(5)①pH=13的Ba(OH)2溶液,C(H+)=10-13mol/L,C(OH-)=
=10-1mol/L,则C(Ba(OH)2)=0.5×c(OH-)=0.05 mol?L-1,
故答案为:0.05 mol?L-1;
②pH=13的Ba(OH)2溶液中氢离子由水电离产生,水电离产生的c(H+)等于溶液中水电离出c(OH -),故水电离出c(OH -)=c(H+)=10-13mol/L,
故答案为:10-13 mol?L-1;
③设盐酸的物质的量浓度为:C(HCl),碱与酸体积分别为1L、9L,则n(OH -)=0.1mol/L×1L=0.1mol,n(H+)=C(HCl)×9L,
反应后剩余氢氧根离子的物质的量为:0.1mol-c(HCl)×9L;
有混合所得溶液pH=11,可知混合后c(H+)=10-11 mol?L-1,则混合后c(OH -)=
=10-3 mol?L-1,
即:
=10-3 mol?L-1,解得:c(HCl)=10-2mol?L-1,pH=-lg[H+],所以pH=2,
故答案为:2.
电解质也不是非电解质;②液态SO2 是化合物,但是本身不能电离出自由移动的离子,属于非电解质;
故选:③④;
(2)Ba(OH)2的电离方程式:Ba(OH)2=Ba 2++2OH-,
故答案为:Ba(OH)2=Ba 2++2OH-;
(3)NaHCO3溶液与NaOH溶液反应的离子方程式为:HCO3-+OH-=H2O+CO32-,
故答案为:HCO3-+OH-=H2O+CO32-;
(4)H2CO3?HCO3-+H+的平衡常数K1=
| [HCO3-][H+] |
| [H2CO3] |
带入平衡常数表达式得K1=4.16×10-7,
故答案为:4.16×10-7;
(5)①pH=13的Ba(OH)2溶液,C(H+)=10-13mol/L,C(OH-)=
| Kw |
| C(H+) |
故答案为:0.05 mol?L-1;
②pH=13的Ba(OH)2溶液中氢离子由水电离产生,水电离产生的c(H+)等于溶液中水电离出c(OH -),故水电离出c(OH -)=c(H+)=10-13mol/L,
故答案为:10-13 mol?L-1;
③设盐酸的物质的量浓度为:C(HCl),碱与酸体积分别为1L、9L,则n(OH -)=0.1mol/L×1L=0.1mol,n(H+)=C(HCl)×9L,
反应后剩余氢氧根离子的物质的量为:0.1mol-c(HCl)×9L;
有混合所得溶液pH=11,可知混合后c(H+)=10-11 mol?L-1,则混合后c(OH -)=
| Kw |
| C(H+) |
即:
| 0.1mol-C(HCl)×9L |
| 10L |
故答案为:2.
点评:本题考查电解质的判断、离子方程式的书写、溶液PH的有关计算、弱电解质的电离等,综合性较大,难度中等,是对知识的综合运用,注意对基础知识灵活应用.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
下列有关离子方程式的书写正确的是( )
| A、氢氧化铜和盐酸的反应:OH-+H+═H2O |
| B、氧化铜和盐酸的反应:Cu2++2H2O═2 H++Cu(OH)2↓ |
| C、铁与硫酸铜溶液的反应:Fe+Cu2+═Cu+Fe2+ |
| D、铁与稀硫酸的反应:Fe+2H+═Fe3++H2↑ |
下列现象或事实可用同一原理解释的是( )
| A、铁分别加入浓硫酸和氢氧化钠溶液中均无明显现象 |
| B、H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率 |
| C、漂白粉溶液和硅酸钠溶液久置空气中都变质 |
| D、SO2既能使品红褪色也能使酸性高锰酸钾褪色 |
最近研制出一种新型燃料电池,一个电极通入空气,另一个电极通入汽油蒸气(以丁烷为汽油代表),电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,下列叙述不正确的是( )
| A、固体电解质中O2-向正极移动,向外电路释放电子的电极是负极 |
| B、这个电池负极发生的反应是:C4H10+13O2--26e-═4CO2+5H2O |
| C、这种电池放电时发生的化学反应方程式为:2C4H10+13O2═8CO2+10H2O |
| D、人们追求燃料电池氧化汽油,而不在内燃机里燃烧汽油产生动力的主要原因是燃料电池具有较高的能量利用率 |
在下列有关晶体的叙述中正确的是( )
| A、晶体中有阳离子就一定存在阴离子 |
| B、分子晶体中一定存在共价键和分子间作用力 |
| C、金属晶体的熔点一定比分子晶体高 |
| D、原子晶体中,一定只存在共价键 |
下列结构中,从成键情况看,不合理的是( )
A、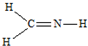 |
B、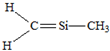 |
C、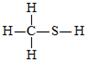 |
D、 |
 中学化学常见的物质A、B、C、D、E、X有如图所示转化关系.已知A、D是单质,B为氧化物,反应①在高温下发生.
中学化学常见的物质A、B、C、D、E、X有如图所示转化关系.已知A、D是单质,B为氧化物,反应①在高温下发生.