题目内容
在下列有关晶体的叙述中正确的是( )
| A、晶体中有阳离子就一定存在阴离子 |
| B、分子晶体中一定存在共价键和分子间作用力 |
| C、金属晶体的熔点一定比分子晶体高 |
| D、原子晶体中,一定只存在共价键 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A、金属晶体是由金属阳离子和自由电子构成的;
B、稀有气体单质是由单原子分子构成的;
C、不同的金属晶体的熔点差别很大,根据常见金属晶体的熔点分析;
D、根据原子晶体中微粒间的作用力分析.
B、稀有气体单质是由单原子分子构成的;
C、不同的金属晶体的熔点差别很大,根据常见金属晶体的熔点分析;
D、根据原子晶体中微粒间的作用力分析.
解答:
解:A、金属晶体是由金属阳离子和自由电子构成的,所以晶体中有阳离子不一定存在阴离子,故A错误;
B、稀有气体单质是由单原子分子构成的分子晶体,分子中没有共价键,所以分子晶体中不一定存在共价键和分子间作用力,故B错误;
C、不同的金属晶体的熔点差别很大,Hg常温下为液态,单质硫属于分子晶体常温下为固体,所以金属晶体的熔点不一定比分子晶体高,故C错误;
D、原子间通过共价键结合形成的空间网状结构的晶体属于原子晶体,故D正确.
故选D.
B、稀有气体单质是由单原子分子构成的分子晶体,分子中没有共价键,所以分子晶体中不一定存在共价键和分子间作用力,故B错误;
C、不同的金属晶体的熔点差别很大,Hg常温下为液态,单质硫属于分子晶体常温下为固体,所以金属晶体的熔点不一定比分子晶体高,故C错误;
D、原子间通过共价键结合形成的空间网状结构的晶体属于原子晶体,故D正确.
故选D.
点评:本题考查了化合键、分子间作用力、晶体等,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
甲、乙两种金属元素:①与稀盐酸反应,甲比乙反应剧烈;②甲原子能与乙的阳离子发生置换反应;③甲的最高价氧化物对应的水化物碱性比乙的最高价氧化物对应的水化物碱性强;④甲与乙用导线连接浸入稀硫酸形成原电池,电流由乙到甲;⑤甲单质的熔沸点比乙的低.能说明甲的金属性比乙强的是( )
| A、只有②③ |
| B、只有②③⑤ |
| C、只有①②③④ |
| D、①②③④⑤ |
下列说法正确的是( )
| A、按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-丙基戊烷 |
B、已知C-C键可以绕键轴自由旋转,结构简式为 ,分子中至少有7个碳原子处于同一直线上 ,分子中至少有7个碳原子处于同一直线上 |
C、 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O5Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O5Na4 |
D、肌醇  与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 |
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
| A、正极反应式为:O2+2H2O+4e-=4OH- |
| B、工作一段时间后,电解液中KOH的物质的量不变 |
| C、该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D、用其作电源电解精炼铜时,纯铜作阳极,而在镀件上电镀铜时金属铜作阴极 |
食品抗氧化剂是能阻止或延缓食品氧化变质、提高食品稳定性和延长贮存期的食品添加剂.BHT是一种常用的食品抗氧化剂,合成方法有如下两种:
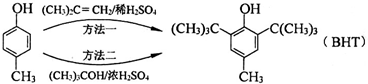
下列说法不正确的是( )

下列说法不正确的是( )
A、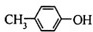 与BHT为同系物 与BHT为同系物 |
B、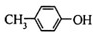 能发生氧化反应 能发生氧化反应 |
| C、BHT不能与NaHCO3溶液反应生成CO2 |
| D、两种方法的反应类型都是加成反应 |
已知:25℃,101KPa下,固体白磷、固体红磷分别充分燃烧,放出热量如下:
①P(s,白磷)+
O2(g)=
P4O10(s) 放出755.2kJ的热
②P(s,红磷)+
O2(g)=
P4O10(s) 放出738.5kJ的热
据此判断下列说法中正确的是( )
①P(s,白磷)+
| 5 |
| 4 |
| 1 |
| 4 |
②P(s,红磷)+
| 5 |
| 4 |
| 1 |
| 4 |
据此判断下列说法中正确的是( )
| A、由白磷变红磷是吸热反应 |
| B、白磷、红磷都是磷的单质,相互可以自由转化,不吸热,也不放热 |
| C、等质量时,白磷比红磷具有的能量高 |
| D、等物质的量时,断白磷分子中的键比断红磷分子中的键消耗的能量多 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、3.4g NH3中含有N-H键数为0.2NA |
| B、100mL 1mol?L-1氨水中,含有OH-离子数为0.1NA |
| C、100mL 2mol?L-1碳酸钠溶液中,Na+离子数为0.4NA |
| D、一定条件下,密闭容器充入1mol N2和3mol H2充分反应,转移的电子数为6NA |
 某化学研究性学习小组设计制取氯气及探究其性质的方案,并按图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O)
某化学研究性学习小组设计制取氯气及探究其性质的方案,并按图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O)