题目内容
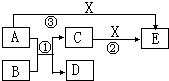 中学化学常见的物质A、B、C、D、E、X有如图所示转化关系.已知A、D是单质,B为氧化物,反应①在高温下发生.
中学化学常见的物质A、B、C、D、E、X有如图所示转化关系.已知A、D是单质,B为氧化物,反应①在高温下发生.(1)若A、D、X为非金属单质,E是常见的温室气体,则A为
(2)若A为金属单质,D为非金属单质,X为盐酸,则反应①的化学方程式为
考点:无机物的推断
专题:推断题
分析:(1)若A、D、X为非金属单质,E是常见的温室气体,则E是CO2,A、C能和X反应且都生成CO2,A是非金属单质,且能生成C,则A是C、X是O2、C是CO,C和H2O在高温下反应生成CO和H2,所以D是H2,B是H2O;
(2)若A为金属单质,D为非金属单质,①的反应在高温条件下,A是Fe,B是H2O,D是H2,C是Fe3O4,X为盐酸,则E是FeCl2.
(2)若A为金属单质,D为非金属单质,①的反应在高温条件下,A是Fe,B是H2O,D是H2,C是Fe3O4,X为盐酸,则E是FeCl2.
解答:
解:(1)若A、D、X为非金属单质,E是常见的温室气体,则E是CO2,A、C能和X反应且都生成CO2,A是非金属单质,且能生成C,则A是C、X是O2、C是CO,C和H2O在高温下反应生成CO和H2,所以D是H2,B是H2O,
通过以上分析知,A是C、X是O2,反应①的方程式为:C+H2O(g)
CO+H2,
故答案为:C;O2;
(2)若A为金属单质,D为非金属单质,①的反应在高温条件下,A是Fe,B是H2O,D是H2,C是Fe3O4,X为盐酸,则E是FeCl2,
①通过以上分析知,高温下,铁和水蒸气反应生成四氧化三铁和氢气,所以①的方程式为3Fe+4H2O(g)
Fe3O4+4H2,②D是四氧化三铁,四氧化三铁和稀盐酸反应生成氯化铁、氯化亚铁和水,离子方程式为Fe3O4+8H+═Fe2++2Fe3++4H2O,故答案为:3Fe+4H2O(g)
Fe3O4+4H2;Fe3O4+8H+═Fe2++2Fe3++4H2O.
通过以上分析知,A是C、X是O2,反应①的方程式为:C+H2O(g)
| ||
故答案为:C;O2;
(2)若A为金属单质,D为非金属单质,①的反应在高温条件下,A是Fe,B是H2O,D是H2,C是Fe3O4,X为盐酸,则E是FeCl2,
①通过以上分析知,高温下,铁和水蒸气反应生成四氧化三铁和氢气,所以①的方程式为3Fe+4H2O(g)
| ||
| ||
点评:本题以C、Fe为载体考查了置换反应,明确物质的性质及反应条件是解本题关键,根据置换反应特点、高温条件来分析解答即可,常见的置换反应有:金属之间的置换反应、金属置换非金属单质、非金属单质置换金属单质、非金属之间的置换反应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
创建和谐社会,保护生存环境是每一个公民的责任和义务.下列做法中,有利于环保环境的是( )
①推广使用可降解塑料 ②城市生活垃圾分类处理
③新农村建设中倡导建造沼气池 ④推广使用一次性木质筷子.
①推广使用可降解塑料 ②城市生活垃圾分类处理
③新农村建设中倡导建造沼气池 ④推广使用一次性木质筷子.
| A、②③④ | B、①②③ |
| C、①②④ | D、①③④ |
甲、乙两种金属元素:①与稀盐酸反应,甲比乙反应剧烈;②甲原子能与乙的阳离子发生置换反应;③甲的最高价氧化物对应的水化物碱性比乙的最高价氧化物对应的水化物碱性强;④甲与乙用导线连接浸入稀硫酸形成原电池,电流由乙到甲;⑤甲单质的熔沸点比乙的低.能说明甲的金属性比乙强的是( )
| A、只有②③ |
| B、只有②③⑤ |
| C、只有①②③④ |
| D、①②③④⑤ |
已知:25℃,101KPa下,固体白磷、固体红磷分别充分燃烧,放出热量如下:
①P(s,白磷)+
O2(g)=
P4O10(s) 放出755.2kJ的热
②P(s,红磷)+
O2(g)=
P4O10(s) 放出738.5kJ的热
据此判断下列说法中正确的是( )
①P(s,白磷)+
| 5 |
| 4 |
| 1 |
| 4 |
②P(s,红磷)+
| 5 |
| 4 |
| 1 |
| 4 |
据此判断下列说法中正确的是( )
| A、由白磷变红磷是吸热反应 |
| B、白磷、红磷都是磷的单质,相互可以自由转化,不吸热,也不放热 |
| C、等质量时,白磷比红磷具有的能量高 |
| D、等物质的量时,断白磷分子中的键比断红磷分子中的键消耗的能量多 |
 某化学研究性学习小组设计制取氯气及探究其性质的方案,并按图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O)
某化学研究性学习小组设计制取氯气及探究其性质的方案,并按图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O)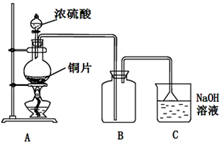 I.Fe2+和I-是两种常见的还原性离子.
I.Fe2+和I-是两种常见的还原性离子.