题目内容
下列现象或事实可用同一原理解释的是( )
| A、铁分别加入浓硫酸和氢氧化钠溶液中均无明显现象 |
| B、H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率 |
| C、漂白粉溶液和硅酸钠溶液久置空气中都变质 |
| D、SO2既能使品红褪色也能使酸性高锰酸钾褪色 |
考点:铁的化学性质,氯、溴、碘及其化合物的综合应用,过氧化氢,二氧化硫的化学性质
专题:元素及其化合物
分析:A.Fe与浓硫酸发生钝化,与NaOH溶液不反应;
B.MnO2或FeCl3溶液均为该反应的催化剂;
C.漂白粉溶液久置空气中与二氧化碳反应生成HClO,且HClO光照分解,硅酸钠溶液久置空气中与二氧化碳反应生成硅酸;
D.SO2能使品红褪色,与其漂白性有关,而能使酸性高锰酸钾褪色,与其还原性有关.
B.MnO2或FeCl3溶液均为该反应的催化剂;
C.漂白粉溶液久置空气中与二氧化碳反应生成HClO,且HClO光照分解,硅酸钠溶液久置空气中与二氧化碳反应生成硅酸;
D.SO2能使品红褪色,与其漂白性有关,而能使酸性高锰酸钾褪色,与其还原性有关.
解答:
解:A.Fe与浓硫酸发生钝化,发生氧化还原反应生成致密的氧化膜阻止反应的进一步发生,而与NaOH溶液不反应,原理不同,故A不选;
B.MnO2或FeCl3溶液均为该反应的催化剂,则H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率,原理相同,故B选;
C.漂白粉溶液久置空气中与二氧化碳反应生成HClO,且HClO光照分解,HClO分解为氧化还原反应,而硅酸钠溶液久置空气中与二氧化碳反应生成硅酸为复分解反应,原理不同,故C不选;
D.SO2能使品红褪色,与其漂白性有关,而能使酸性高锰酸钾褪色,发生氧化还原反应,与二氧化硫还原性有关,则褪色原理不同,故D不选;
故选B.
B.MnO2或FeCl3溶液均为该反应的催化剂,则H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率,原理相同,故B选;
C.漂白粉溶液久置空气中与二氧化碳反应生成HClO,且HClO光照分解,HClO分解为氧化还原反应,而硅酸钠溶液久置空气中与二氧化碳反应生成硅酸为复分解反应,原理不同,故C不选;
D.SO2能使品红褪色,与其漂白性有关,而能使酸性高锰酸钾褪色,发生氧化还原反应,与二氧化硫还原性有关,则褪色原理不同,故D不选;
故选B.
点评:本题考查物质的性质,为高频考点,综合考查元素化合物的性质,把握物质的性质及发生的反应为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列操作中错误的是( )
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、混入Cl2中的HCl气体,可用饱和NaCl溶液除去 |
| C、除去Fe粉中的少量铝粉:加入NaOH溶液后过滤 |
| D、提取溶解在水中的少量溴:加入CCl4,振荡,静置,分层后,取出有机层再分离 |
甲、乙两种金属元素:①与稀盐酸反应,甲比乙反应剧烈;②甲原子能与乙的阳离子发生置换反应;③甲的最高价氧化物对应的水化物碱性比乙的最高价氧化物对应的水化物碱性强;④甲与乙用导线连接浸入稀硫酸形成原电池,电流由乙到甲;⑤甲单质的熔沸点比乙的低.能说明甲的金属性比乙强的是( )
| A、只有②③ |
| B、只有②③⑤ |
| C、只有①②③④ |
| D、①②③④⑤ |
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
| A、正极反应式为:O2+2H2O+4e-=4OH- |
| B、工作一段时间后,电解液中KOH的物质的量不变 |
| C、该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D、用其作电源电解精炼铜时,纯铜作阳极,而在镀件上电镀铜时金属铜作阴极 |
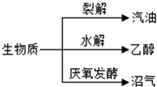 生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )| A、沼气的主要成分是甲烷 |
| B、汽油属于一次能源 |
| C、乙醇属于可再生能源 |
| D、生物质能来源于太阳能 |
 I.Fe2+和I-是两种常见的还原性离子.
I.Fe2+和I-是两种常见的还原性离子.