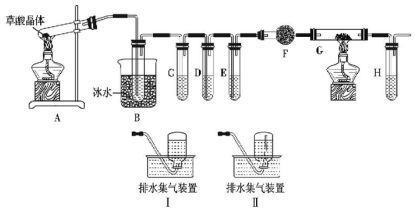
题目内容
18.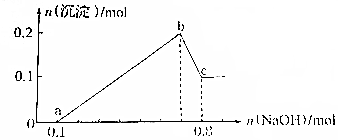 某溶液中可能含有H+、Mg2+、Al3+、Fe3+、Na+等阳离子中的一种或几种,当向该溶液中加入NaOH溶液时,产生沉淀的物质的量与所加NaOH物质的量之间的关系如图所示
某溶液中可能含有H+、Mg2+、Al3+、Fe3+、Na+等阳离子中的一种或几种,当向该溶液中加入NaOH溶液时,产生沉淀的物质的量与所加NaOH物质的量之间的关系如图所示请回答以下问题:
(1)b、c之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
(2)若该溶液的体积为50mL,则c(Al3+)=0.05mol/L.
(3)依据图中数据分析,除Al3+外,溶液中还含有的离子有H+,Fe3+.
分析 加入NaOH后,在0-a段没有生成沉淀,说明溶液中一定存在H+,由于后面沉淀生成及沉淀部分溶解可知溶液中一定存在Al3+,a-b段生成沉淀消耗了0.6molNaOH,溶液中可能存在Mg2+,Fe3+,Al3+,b-c段沉淀溶解,可知溶液中一定存在Al3+,根据图象Al(OH)3的物质的量与剩余沉淀的物质的量相等,由OH-~AlO2-可知溶解Al(OH)3消耗了0.1molNaOH,所以生成沉淀消耗了0.3molNaOH,另一种离子生成沉淀的量也消耗了0.3molNaOH,所明另一种离子为3价离子,则为Fe3+,
(1)b-c段沉淀溶解,故发生的反应为Al(OH)3+OH-=AlO2-+H2O;
(2)由b-c段沉淀溶解,故发生的反应为Al(OH)3+OH-=AlO2-+H2O,消耗0.1molNaOH,故消耗0.1molAl(OH)3,根据铝元素守恒,则n(Al3+)=n(Al(OH)3),据c=$\frac{n}{V}$进行计算;
(3)由题干分析可知.
解答 解:加入NaOH后,在0-a段没有生成沉淀,说明溶液中一定存在H+,由于后面沉淀生成及沉淀部分溶解可知溶液中一定存在Al3+,a-b段生成沉淀消耗了0.6molNaOH,溶液中可能存在Mg2+,Fe3+,Al3+,b-c段沉淀溶解,可知溶液中一定存在Al3+,根据图象Al(OH)3的物质的量与剩余沉淀的物质的量相等,由OH-~AlO2-可知溶解Al(OH)3消耗了0.1molNaOH,所以生成沉淀消耗了0.3molNaOH,另一种离子生成沉淀的量也消耗了0.3molNaOH,所明另一种离子为3价离子,则为Fe3+,
(1)b-c段沉淀溶解,故发生的反应为Al(OH)3+OH-=AlO2-+H2O,故答案为:Al(OH)3+OH-=AlO2-+H2O;
(2)由b-c段沉淀溶解,故发生的反应为Al(OH)3+OH-=AlO2-+H2O,消耗0.1molNaOH,故消耗0.1molAl(OH)3,根据铝元素守恒,则n(Al3+)=n(Al(OH)3),则c=$\frac{n}{V}$=$\frac{0.1mol}{0.05L}$=0.05mol/L,故答案为:0.05mol/L;
(3)由以上分析可得溶液中还含有的离子有H+,Fe3+,故答案为:H+,Fe3+.
点评 本题考查离子共存、反应图象识别以及离子反应有关计算等,是高考中的常见题型,对学生的综合能力提出了更高的要求,有利于培养学生的逻辑思维能力和发散思维能力,难度较大.

| A. | 晶体硅是良好的半导体材料 | |
| B. | 铁、铝合金的熔点高于铁的熔点,硬度小 | |
| C. | 氨常用作制冷剂利用了氨的化学性质 | |
| D. | 漂白粉、明矾都可用于污水的净化,其原理是相同的 |
| A. | 用分液漏斗分离乙醇和乙酸乙酯的混合物 | |
| B. | 新制氯水或浓硝酸存放在带橡皮塞的棕色玻璃瓶中 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 加热蒸发NaCl溶液时应用玻璃棒不断搅拌 |
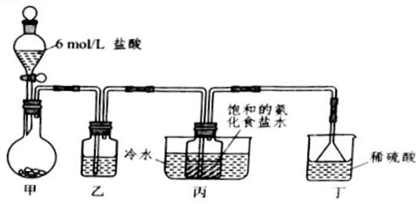
 (1)已知在常温常压下:
(1)已知在常温常压下: