��Ŀ����
19��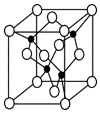 X��Y��Z��U��W ��ԭ���������������ǰ������Ԫ�أ����� Y ��ԭ�Ӻ����� 7 ���˶�״̬��ͬ�� ���ӣ�X��Z ��δ�ɶԵ�������Ϊ 2��U �ǵ�������Ԫ���γɵļ������а뾶��С��Ԫ�أ�W ���ڲ�� ��ȫ�����������ֻ�� 1 �����ӣ���ش��������⣺
X��Y��Z��U��W ��ԭ���������������ǰ������Ԫ�أ����� Y ��ԭ�Ӻ����� 7 ���˶�״̬��ͬ�� ���ӣ�X��Z ��δ�ɶԵ�������Ϊ 2��U �ǵ�������Ԫ���γɵļ������а뾶��С��Ԫ�أ�W ���ڲ�� ��ȫ�����������ֻ�� 1 �����ӣ���ش��������⣺��1��U �����ڱ��е�λ�õ�������IIIA�壮X��Y��Z �ĵ�һ�����ܴӴ�С��˳����N��O��C����Ԫ�ط��ű�ʾ����ͬ����
��2��д�� W �ļ۵����Ų�ͼ
 ��
����3�����ݵȵ�����ԭ������֪������ XZ �ĵ���ʽ��
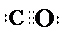 ��
���� 4 �� X��Y��Z ������⻯��ļ��ǴӴ�С��˳����CH4��NH3��H2O�� �û�ѧʽ��ʾ����ԭ�� ��3���⻯�������ԭ�Ӽ۲���Ӷ�����Ϊ4��VSEPRģ�;�Ϊ���������Σ�������ԭ�ӵŵ��Ӷ������������¼��DZ�С��
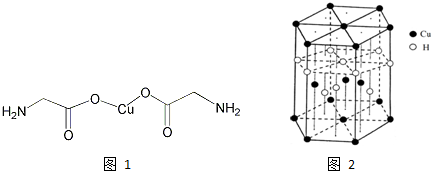
��5����Ԫ�� Y �� U Ԫ����ɵĻ����� A�������ṹ����ͼ��ʾ�������ʾ Y ԭ�ӣ������ʾ U ԭ�ӣ�����д�������� A �Ļ�ѧʽAlN������ Y Ԫ�ص��ӻ���ʽ ��sp3��
��6��U �ľ�����������ϵ���侧���߳�Ϊ 405pm���ܶ��� 2.70g/cm��ͨ������ȷ�� �侧�������������������ܶѻ�����������ѻ������������ѻ��������������ܶ� ��������֪��4053��6.64��107��
���� X��Y��Z��U��W��ԭ���������������ǰ������Ԫ�أ�����Y��ԭ�Ӻ�����7���˶�״̬��ͬ�ĵ��ӣ���YΪNԪ�أ�U�ǵ�������Ԫ���γɵļ������а뾶��С��Ԫ�أ���UΪAl��X��Z��δ�ɶԵ�������Ϊ2��X��ԭ������С��N����Z��ԭ����������N��Al֮�䣬X��Z�ĺ�������Ų��ֱ�Ϊ1s22s22p2��1s22s22p4����XΪCԪ�ء�ZΪOԪ�أ�W���ڲ����ȫ�����������ֻ��1�����ӣ�ԭ����������Al��ֻ�ܴ��ڵ������ڣ����������Ϊ2+8+18+1=29����WΪCuԪ�أ��Դ˽����⣮
��� �⣺��1�������Ϸ�����֪UΪAl��λ�����ڱ���ͬ������ԭ����������һ�����ܳ��������ƣ���NԪ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������N��O��C��
�ʴ�Ϊ���������� IIIA �壻N��O��C��
��2��WΪCuԪ�أ��۵����Ų�ʽΪ3d104s1���۵����Ų�ͼΪ ��
��
�ʴ�Ϊ�� ��
��
��3�����ݵȵ�����ԭ������֪������CO��N2��Ϊ�ȵ����壬CO�ĵ���ʽ��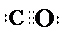
�ʴ�Ϊ��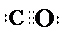
��4��X��Y��Z������⻯��ֱ�ΪCH4��NH3��H2O��3���⻯�������ԭ�Ӽ۲���Ӷ�����Ϊ4��VSEPRģ�;�Ϊ���������Σ�������ԭ�ӵŵ��Ӷ������������¼��DZ�С���ʼ��ǣ�CH4��NH3��H2O��
�ʴ�Ϊ��CH4��NH3��H2O��3���⻯�������ԭ�Ӽ۲���Ӷ�����Ϊ4��VSEPRģ�;�Ϊ���������Σ�������ԭ�ӵŵ��Ӷ������������¼��DZ�С��
��5��������Nԭ����ĿΪ4��Alԭ����ĿΪ8��$\frac{1}{8}$+6��$\frac{1}{2}$=4���ʸû����ﻯѧʽΪAlN��Yԭ���γ�4�����ۼ�����Yԭ���ӻ���ʽΪsp3��
�ʴ�Ϊ��AlN��sp3��
��6���辧����Alԭ����ĿΪN��Al������N��Al����$\frac{27}{6.02��1{0}^{23}}$g=��405��10-10��3��2.70g/cm3�����N��Al��=4.00�������侧�����������������ܶѻ���
�ʴ�Ϊ�������������ܶѻ���
���� �����Ƕ����ʽṹ�����ʵĿ��飬Ϊ�߿��������ͣ����ؿ���ѧ���ķ��������ͼ����������漰��������Ų��������ܡ��ӻ���ʽ����������ȣ��Ѷ��еȣ�ע����վ����ļ���ͷ�����

 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д��ٳ������������Խ��Ŀ���Խ���������彡��
��úȼ��ʱ����������ʯ��ʯ���ɼ��ٷ�����SO2����
��PH��5.6��7.0֮��Ľ�ˮͨ����Ϊ����
������β���к��е������̼�������Ǧ������ȣ�������Ⱦ������
| A�� | �٢� | B�� | �٢� | C�� | �ۢ� | D�� | �ڢ� |
| A�� | CH2=CH2 | B�� | CH��C-CH3 | C�� | CH2=CH-CH=CH2 | D�� | CH3-CH=CH2 |
��1��ѡ����ͼ��ʾ��װ�ã������ظ�ѡ�ã�����ʵ�飬װ���������ӵĺ���˳��ΪABDCEDF��
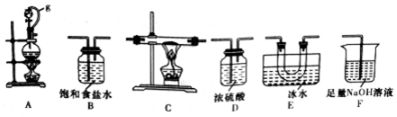
��2��ͼ��g�ܵ������DZ�����ѹƽ�⣬���ڷ�Һ©���е�Һ������������ƿ��װ��E���������������ռ�BCl3��
��3����ʼʵ��ʱ���ȵ�ȼA���A����B�������ľƾ��ƣ�
��4����д��BCl3��ˮ���ʵĻ�ѧ����ʽBCl3+3H2O=H3BO3+3HCl��
��5��������һԪ���ᣬ�����λ�ѧʽΪNa����������ˮ�е��뷽��ʽ��H3BO3+H2O?[B��OH��4]-+H+��
��6��ʵ����ɺ�ijͬѧ��F ����Һ�к���0.05mol/LNaC1 0��0.05mol/LNaCl��0.1mol/L NaOH���еμ�Ʒ����Һ��������Һ��ɫ�������ʵ��̽����Һ��ɫ��ԭ���뽫�������ݲ������������ʵ�鷽����
| ʵ����� | 0.1mol/LNaClO��Һ/mL | 0.1mol/LNaCl��Һ/mL | 0.2mol/LNaOH��Һ/mL | H2O/mL | Ʒ����Һ | ���� |
| �� | 4.0 | 0 | 0 | x | 3�� | �Ͽ���ɫ |
| �� | 0 | 4.0 | 4.0 | 0 | 3�� | ����ɫ |
| �� | 4.0 | 0 | 4.0 | 0 | 3�� | ������ɫ |
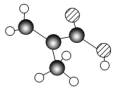 ij����ֻ��C��H��O����Ԫ�أ������ģ����ͼ��ʾ�������й���12��ԭ�ӣ�ͼ��������֮������ߴ���������˫���Ȼ�ѧ������
ij����ֻ��C��H��O����Ԫ�أ������ģ����ͼ��ʾ�������й���12��ԭ�ӣ�ͼ��������֮������ߴ���������˫���Ȼ�ѧ������ ��
��