题目内容
14.向100mL稀H2SO4和稀HCl的混合溶液中,加入8.55g Ba(OH)2粉末,充分反应后过滤、干燥,得到沉淀物4.66g,所得溶液中OH-的浓度为0.1mol•L-1,试求:(1)原混合液中H2SO4的 物质的量浓度 (假设反应前后溶液体积不变).
(2)原混合液中Cl-的 物质的量.
分析 (1)依据氢氧化钡物质的量计算氢氧化钡的物质的量,滤液呈碱性,那么可知硫酸和盐酸全部消耗掉,依据生成沉淀的质量计算硫酸钡的物质的量,即硫酸的物质的量,据此计算硫酸的物质的量浓度;
(2)依据所得溶液中OH-的浓度为0.1mol•L-1,计算剩余的氢氧根离子物质的量,据此计算盐酸电离出的氢离子,从而求出盐酸的物质的量及氯离子物质的量浓度,据此解答.
解答 解:(1)8.55g Ba(OH)2粉末物质的量为$\frac{8.55g}{171g/mol}$=0.05mol,含有氢氧根离子物质的量为0.05mol×2=0.1mol;得到硫酸钡物质的量为:$\frac{4.66g}{233g/mol}$=0.02mol,依据H2SO4+Ba(OH)2=BaSO4+2H2O可知,原溶液中含有硫酸的物质的量为0.02mol,所以硫酸的物质的量浓度为$\frac{0.02mol}{0.1L}$=0.2mol/L;
答:原混合液中H2SO4的物质的量浓度为0.2mol/L;
(2)依据题意反应后所得溶液中OH-的浓度为0.1mol•L-1,含有氢氧根离子物质的量为0.1mol/L×0.1L=0.01mol,设原溶液中含有氯化氢物质的量为xmol,则:0.1mol-0.02mol×2-x×1=0.01mol,解答x=0.05mol,氯化氢为强电解质,所以氯离子物质的量等于氯化氢物质的量为0.05mol;
答:原混合液中Cl-的物质的量0.05mol.
点评 本题考查物质的量浓度的计算、离子反应的有关计算等,难度中等,注意根据酸碱中和时离子的关系来解答.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
6.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 验证Fe(NO3)2是否变质 | 将Fe(NO3)2溶于稀硫酸中,再滴加KSCN溶液,观察是否变化 |
| B | 制备Fe(OH)3胶体 | 向沸水中滴加饱和FeCl3溶液,加热并搅拌 |
| C | 证明氧化性H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| D | 验证Ksp(AgI)<Ksp(AgCl) | 向AgCl的悬浊液中滴加KI溶液,出现黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
2.取ag某可燃物在氧气中完全燃烧,将其产物通过足量的过氧化钠固体充分吸收,反应后固体的质量增加了bg,满足a>b的是( )
| A. | H2 | B. | HCOOH | C. | C6H12O6 | D. | C12H22O11 |
6.化学在生产、生活中应用广泛,下列说法正确的是( )
| A. | 晶体硅是良好的半导体材料 | |
| B. | 铁、铝合金的熔点高于铁的熔点,硬度小 | |
| C. | 氨常用作制冷剂利用了氨的化学性质 | |
| D. | 漂白粉、明矾都可用于污水的净化,其原理是相同的 |
4.1mol某烃最多能和2mol HBr加成,且产物最多能与8mol Cl2发生取代反应,则该烃可能为( )
| A. | CH2=CH2 | B. | CH≡C-CH3 | C. | CH2=CH-CH=CH2 | D. | CH3-CH=CH2 |
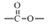 结构
结构 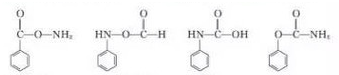 .
. (1)已知在常温常压下:
(1)已知在常温常压下: