题目内容
11.25℃时,甲、乙两烧杯分别盛有5mL pH=1的盐酸和硫酸,下列描述中不正确的是( )| A. | 物质的量浓度:c甲=2c乙 | |
| B. | 水电离出的OH-浓度:c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙 | |
| D. | 将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>1 |
分析 盐酸是一元强酸,硫酸是二元强酸,其pH相等说明氢离子浓度相等,据此分析.
解答 解:盐酸是一元强酸,硫酸是二元强酸,其pH相等说明氢离子浓度相等,
A、盐酸和硫酸溶液中氢离子浓度相等时,盐酸浓度为硫酸浓度的2倍,即c甲=2c乙,故A正确;
B、pH相等说明氢离子浓度相等,则氢氧根离子浓度也相等,故B正确;
C、pH相等说明氢离子浓度相等,若分别用等浓度的NaOH溶液完全中和,所得溶液的pH都为7,故C正确;
D、甲、乙烧杯中溶液混合时,若不考虑体积变化,氢离子浓度不变,故D错误;
故选D.
点评 本题考查了pH的含有,注意pH相等即氢离子浓度相等,与强酸是几元酸无关,题目难度不大.

练习册系列答案
相关题目
1.检验铵盐的方法是将待检物取出少量放在试管中,然后( )
| A. | 加热,用湿润的红色石蕊试纸在试管口观察现象 | |
| B. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| C. | 加强碱溶液,加热,滴入酚酞试液,观察溶液颜色 | |
| D. | 加苛性钠溶液,加热,用湿润的红色石蕊试纸在试管口进行检验 |
19.下列物质中属于电解质的是( )
| A. | 硫酸钡 | B. | 氯气 | C. | 铜 | D. | 蔗糖 |
6.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1.8gNH${\;}_{4}^{+}$和2.3gNa+所含的电子数均为NA | |
| B. | 0.4molCu与0.8molHNO3(稀)反应,转移电子数为0.8NA | |
| C. | 3.2gCu与足量的HNO3(浓)反应生成的气体分子数为0.1NA | |
| D. | 1molCl2与足量的铁反应,转移的电子数为3NA |
5.下列元素中,电负性最大的是( )
| A. | Na | B. | F | C. | O | D. | Cs |
12.设NO+NO2?NO2+CO(正反应吸热)反应速率为v1;N2+3H2?NH3(正反应放热)反应速率为v2.对于前述反应,当温度升高时,v1和v2变化情况为( )
| A. | v1增大,v2减小 | B. | v1减小,v2增大 | C. | 同时增大 | D. | 同时减小 |
10.X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4.R、M同主族,R与冷水即可反应,M与热水反应缓慢.下列关系正确的是( )
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性R(OH)2<M(OH)2 |
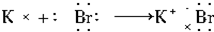
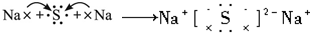
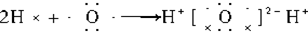

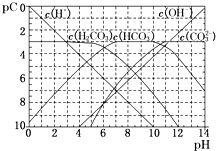 研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.
研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.