题目内容
9. 研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.
研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.I、碳单质能够参与反应制备重要材料半导体,其化学反应方程式为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
II、碳氢化合物是重要的能源物质.丙烷脱氢可得丙烯.
(1)已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)
△H1=156.6kJ•mol-1
CH3CH═CH2(g)→CH4(g)+HC≡CH(g )△H2=32.4kJ•mol-1
则相同条件下,由气态C3H8生成丙烯和氢气的热化学方程式为:C3H8(g)=CH3CH=CH2(g)+H2(g)△H=+124.2 kJ•mol-1
(2)以甲烷为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲烷,电解质是氢氧化钾溶液.电池负极反应式为CH4-8e-+10OH-=CO32-+7H2O;
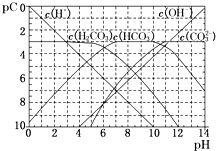
Ⅲ、pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值.如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3.如图为25℃时H2CO3溶液的pC-pH图.请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)
①在同一溶液中,H2CO3、HCO3-、CO32-不能(填“能”或“不能”)大量共存.
②H2CO3一级电离平衡常数的数值Ka1≈10-6.
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH≈7.4.当过量的酸进入血液中时,血液缓冲体系中的$\frac{c({H}^{+})}{c({H}_{2}C{O}_{3})}$最终将A.
A.变大 B.变小 C.基本不变 D.无法判断.
分析 Ⅰ.碳和二氧化硅高温反应生成硅和一氧化碳;
Ⅱ.(1)依据热化学方程式结合盖斯定律计算得到;
(2)燃料电池中,负极上燃料失电子发生氧化反应;
Ⅲ.①根据离子存在溶液的酸碱性判断;
②由图象可知当pH=6时,pC(H2CO3)=pC(HCO3-),结合Ka1(H2CO3)=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$计算;
③氢离子浓度增大,导致平衡向左移动;
解答 解:Ⅰ.碳单质能够参与反应制备重要材料半导体诶硅,反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
Ⅱ.(1)①C3H8(g)=CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ•mol-1
②CH3CH=CH2(g)=CH4(g)+HC≡CH(g )△H2=+32.4kJ•mol-1
依据盖斯定律①-②得到热化学方程式为:C3H8(g)=CH3CH=CH2(g)+H2(g)△H=+124.2 kJ•mol-1 ;
故答案为:C3H8(g)=CH3CH=CH2(g)+H2(g)△H=+124.2 kJ•mol-1 ;
(2)甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;
Ⅲ.①碳酸存在的溶液中酸性较强、碳酸根离子存在的溶液中碱性较强,所以碳酸根离子和碳酸不能大量共存,故答案为:不能;
②由图象可知当pH=6时,pC(H2CO3)=pC(HCO3-),结合Ka1(H2CO3)=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=$\frac{1{0}^{-6}c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=10-6,故答案为:10-6;
③氢离子浓度增大,平衡向左移动放出CO2,碳酸浓度基本不变,则c(H+)/c(H2CO3)最终将变大,故选A,故答案为:A;
点评 本题注重考查了热化学方程式的书写,盖斯定律的运用以及热量的计算、电极反应离的书写,明确燃料电池的原理、弱电解质的电离、图象中Pc的含义是解本题关键,题目难度中等.

| A. | BaCl2溶液 | B. | HCl溶液 | C. | Na2CO3溶液 | D. | NaNO3溶液 |
| A. | 物质的量浓度:c甲=2c乙 | |
| B. | 水电离出的OH-浓度:c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙 | |
| D. | 将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>1 |
| A. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| B. | H216O、D216O、H218O、D218O互为同素异形体 | |
| C. | 明矾和漂白粉常用于自来水的净化或杀菌消毒,但两者的作用原理不同 | |
| D. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 |
| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
| A. | 用加热煮沸的方法将硬水软化 | |
| B. | 图书、档案、贵重设备等失火时可以用二氧化碳灭火器灭火 | |
| C. | 包装食品使用的聚氯乙烯塑料袋,可以用加热的方法封口 | |
| D. | 炉具清洁剂中含有氢氧化钠能与油脂发生反应,可以用于去除油污 |
| A. | 常温常压下,11.2L氮气所含的原子数为NA | |
| B. | 1mol硫与铁充分反应转移的电子数为2NA | |
| C. | 常温常压下,48gSO3含有的分子数为3NA | |
| D. | 常温常压下,1molNO2气体与水反应生成NA个NO3-离子 |