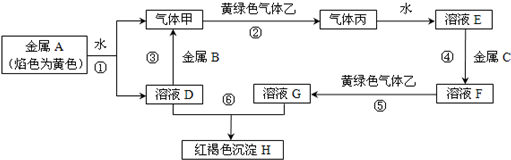
题目内容
1.检验铵盐的方法是将待检物取出少量放在试管中,然后( )| A. | 加热,用湿润的红色石蕊试纸在试管口观察现象 | |
| B. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| C. | 加强碱溶液,加热,滴入酚酞试液,观察溶液颜色 | |
| D. | 加苛性钠溶液,加热,用湿润的红色石蕊试纸在试管口进行检验 |
分析 检验铵盐溶液的方法是:铵盐和氢氧化钠在加热条件下生成氨气,氨气能使湿润红色石蕊试纸会变蓝色,由原子守恒来判断为铵盐.
解答 解:A.直接加热铵盐晶体虽然也可分解产生氨气,但同时会生成其他气体,混合气体及水蒸气在到达试管口之前即又冷却化合成为原铵盐晶体附着在试管壁上,故无法使湿润红色石蕊试纸变蓝,故A错误;
B.铵盐和水混合不会产生氨气,将湿润的红色石蕊试纸放在试管中会显示红色,是因为铵根离子水解显示酸性,但是显酸性的溶液不一定是铵盐,故B错误;
C、加强碱溶液后加热,再滴入无色酚酞试液,因为强碱溶液呈碱性,不能确定是否有铵根离子,故C错误;
D.将白色固体放入试管加热,用湿润的红色石蕊试纸放在试管口,湿润红色石蕊试纸会变蓝色,证明产生的气体是氨气,则该盐中含有铵根离子,这是检验铵盐的方法,故D正确.
故选D.
点评 本题考查物质的检验,为高频考点,侧重于学生的分析、实验和评价能力的考查,注意把握物质的性质以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列有机物分子中,在核磁共振氢谱图中只给出一种峰(信号)的是( )
| A. | CH3-CH3 | B. | CH3COOH | C. | CH3COOCH3 | D. | CH3COCH3 |
9.对于①干冰②金刚石③氯化钠三种物质的熔沸点由高到低排列顺序正确的是( )
| A. | ①②③ | B. | ③②① | C. | ②①③ | D. | ②③① |
16.空气污染已成为人类社会面临的重大威胁.下列气体中,会造成空气污染的是( )
| A. | N2 | B. | O2 | C. | CO2 | D. | SO2 |
13.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
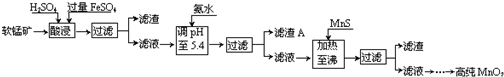
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)FeSO4在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)pH要调到5.4,应该使用pH计或精密pH试纸(填写仪器或试剂名称)来测量.滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-.
(4)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-═MnO2+4H+.
(5)已知25℃时,Ksp[Fe(OH)3]=2•79×10-58,该温度下反应Fe(OH)3+3H+═Fe3++3H2O的平衡常数K=2.79×103.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)pH要调到5.4,应该使用pH计或精密pH试纸(填写仪器或试剂名称)来测量.滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-.
(4)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-═MnO2+4H+.
(5)已知25℃时,Ksp[Fe(OH)3]=2•79×10-58,该温度下反应Fe(OH)3+3H+═Fe3++3H2O的平衡常数K=2.79×103.
10.只用一种试剂就可将AgNO3、稀HNO3、NaOH三种溶液一次区分开,这种试剂是( )
| A. | BaCl2溶液 | B. | HCl溶液 | C. | Na2CO3溶液 | D. | NaNO3溶液 |
11.25℃时,甲、乙两烧杯分别盛有5mL pH=1的盐酸和硫酸,下列描述中不正确的是( )
| A. | 物质的量浓度:c甲=2c乙 | |
| B. | 水电离出的OH-浓度:c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙 | |
| D. | 将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>1 |
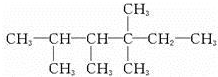
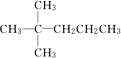 .
. 、
、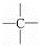 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如: