题目内容
2.下列各式是用电子式表示的对应物质形成的过程,其中正确的是( )| A. |  | |
| B. |  | |
| C. |  | |
| D. |  |
分析 A、KBr为离子化合物,由钾离子和溴离子构成;
B、硫化钠为离子化合物,根据离子化合物的电子式结合电子转移然后写出Na2S的形成过程;
C、水为共价化合物,两个氢原子分别与氧原子形成共价键;
D、电子式中,相同离子不能合并.
解答 解:A、KBr为离子化合物,由钾离子和溴离子构成,故其形成过程为 ,故A错误;
,故A错误;
B、硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为: ,故B正确;
,故B正确;
C、水为共价化合物,两个氢原子分别与氧原子形成共价键,H2O的形成过程: ,故C错误;
,故C错误;
D、氯化钙为离子化合物,且电子式中,相同离子不能合并,故用电子式表示下列物质的形成过程为 ,故D错误.
,故D错误.
故选B.
点评 本题考查了用电子式表示物质的形成过程,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别,能够用电子式正确表示化合物的形成过程.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
12.下列有机物分子中,在核磁共振氢谱图中只给出一种峰(信号)的是( )
| A. | CH3-CH3 | B. | CH3COOH | C. | CH3COOCH3 | D. | CH3COCH3 |
13.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
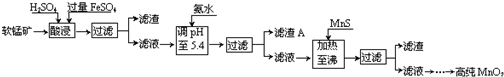
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)FeSO4在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)pH要调到5.4,应该使用pH计或精密pH试纸(填写仪器或试剂名称)来测量.滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-.
(4)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-═MnO2+4H+.
(5)已知25℃时,Ksp[Fe(OH)3]=2•79×10-58,该温度下反应Fe(OH)3+3H+═Fe3++3H2O的平衡常数K=2.79×103.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)pH要调到5.4,应该使用pH计或精密pH试纸(填写仪器或试剂名称)来测量.滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-.
(4)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-═MnO2+4H+.
(5)已知25℃时,Ksp[Fe(OH)3]=2•79×10-58,该温度下反应Fe(OH)3+3H+═Fe3++3H2O的平衡常数K=2.79×103.
10.只用一种试剂就可将AgNO3、稀HNO3、NaOH三种溶液一次区分开,这种试剂是( )
| A. | BaCl2溶液 | B. | HCl溶液 | C. | Na2CO3溶液 | D. | NaNO3溶液 |
17.在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是( )
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 恰好完全反应时,溶液不易导电,所以BaSO4和水都是弱电解质 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
7.下列加点字的含义不是指“元素”的是( )
| A. | 碘 遇淀粉变蓝 | B. | 钠 的焰色反应为黄色 | ||
| C. | 矿泉水中含有钙、镁等矿物质 | D. | 磷的同素异形体有红磷、白磷等 |
11.25℃时,甲、乙两烧杯分别盛有5mL pH=1的盐酸和硫酸,下列描述中不正确的是( )
| A. | 物质的量浓度:c甲=2c乙 | |
| B. | 水电离出的OH-浓度:c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙 | |
| D. | 将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>1 |

 ;(任写一种)
;(任写一种)

 、
、 .
. .
.