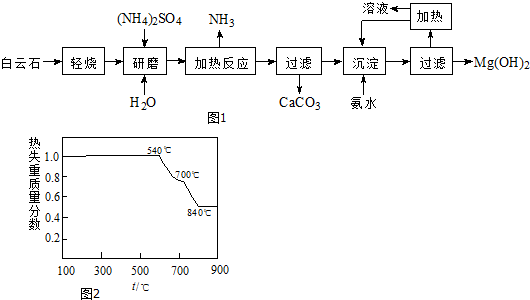
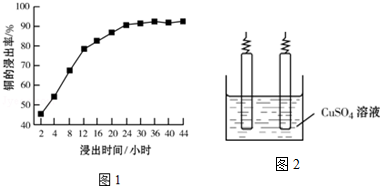
题目内容
11.向3L密闭容器中通入x mol气体 A和ymol气体B,在一定条件下发生反应;mA(g)+nB(g)?pC(g)+qD(g)已知:平均反应速率vC=2vA;反应4min时,A的浓度减少为原来的$\frac{1}{3}$倍,B的物质的量减少了x mol,有2x mol D生成.回答下列问题:
(1)反应4min内,vA=$\frac{x}{18}$ mol/(L•min),vc=$\frac{x}{9}$ mol/(L•min);
(2)化学方程式中,m=2、q=6;
(3)若6min时,反应达到平衡,D为2.4x mol,则B的转化率为$\frac{1.2x}{y}$×100%;
(4)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:反应速率增大(填“增大”、“减小”或“不变”),理由是将容器的容积变为1L,相当于压强增大,反应速率增大;
(5)下列叙述不能说明该反应已达到化学平衡状态的是A.
A.混合气体密度不变 B.容器内压强不变
C.混合气体的平均相对分子质量不变
D.若只有B是有色气体,且容器内气体颜色深浅不变
E.各物质的质量分数不变.
分析 (1)反应4min时,A的浓度减少为原来的$\frac{1}{3}$倍,则A反应了原来的$\frac{2}{3}$倍,根据vA=$\frac{△c}{△t}$,再根据vC=2vA计算vC;
(2)根据个物质的转化量之比,由反应之比等于化学计量数之比得m、q的值;
(3)根据反应计量数由D计算出B的转化量,再算转化率;
(4)压强增大,反应速率加快;
(5)A.根据ρ=$\frac{m}{V}$; B.反应是个体积改变的反应,压强不变到达平衡;C.混合气体的平均相对分子质量不变=$\frac{m}{n}$;D.容器内气体颜色深浅与浓度有关E.平衡状态时各物质的质量分数不变.
解答 解:(1)反应4min时,A的浓度减少为原来的$\frac{1}{3}$倍,则A反应了原来的$\frac{2}{3}$倍,vA=$\frac{△c}{△t}$=$\frac{\frac{xmol}{3L}×\frac{2}{3}}{4min}$=$\frac{x}{18}$mol/(L•min),vC=2vA=2×$\frac{x}{18}$mol/(L•min)=$\frac{x}{9}$mol/(L•min);
故答案为:$\frac{x}{18}$mol/(L•min);$\frac{x}{9}$mol/(L•min);
(2)由(1)知A反应$\frac{2}{3}$x,B的物质的量减少了x mol,C生成2×$\frac{2}{3}$x=$\frac{4}{3}$x,有2x mol D生成,则参与反应的物质的量之比为$\frac{2}{3}$x:x:$\frac{4}{3}$x:2x=2:3:4:6.反应为2A(g)+3B(g)?4C(g)+6D(g);
故答案为:2;6;
(3)6min时,反应达到平衡,D为2.4x mol,则反应的B有$\frac{1}{2}$×2.4x=1.2x,则B的转化率为$\frac{1.2x}{y}$×100%;
故答案为:$\frac{1.2x}{y}$×100%;
(4)将容器的容积变为1L,相当于压强增大,则反应速率增大;
故答案为:增大;将容器的容积变为1L,相当于压强增大,反应速率增大;
(5)A.混合气体密度ρ=$\frac{m}{V}$,物质均为气体,气体总质量不变,恒容体积不变,密度始终不变,不能说明达到平衡状态,所以A不可以;
B.该反应是个体积增大的反应,恒容压强会增大,容器内压强不变时达到平衡状态,所以B可以;
C.混合气体的平均相对分子质量=$\frac{{m}_{总}}{{n}_{总}}$,总质量不变,总物质的量变大,平均相对分子质量变小,当不变时,说明达到平衡状态,所以C可以;
D.若只有B是有色气体,则气体颜色深浅与浓度有关,容器内气体颜色深浅不变时,说明B的浓度恒定,达到平衡,所以D可以;
E.达到平衡时各物质的浓度百分量恒定,各物质的质量分数不变,所以E可以;
故答案为:A.
点评 本题考查化学平衡的计算,涉及反应速率的计算、转化率的计算、反应速率、平衡移动的影响因素及化学平衡状态的判断,综合性较强,注重高考常考考点的考查,题目难度中等.

| A. | 4g氢气中含有的原子数是2mol | |
| B. | 4g氢气所占的体积是44.8L | |
| C. | 4g氢气的物质的量是2mol | |
| D. | 4g氢气与44.8L氧气所占有的体积相同 |
(1)a>b(填“>”、“<”或“=”).
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”、“<”或“=”).
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
a=b+c(用代数式表示).
(3)在相同条件下要想得到2a kJ的热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2 和2molC3
A.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量为d kJ,则d>b(填“>”、“<”或“=”),理由是恒压容器压强保持不变,随着反应的进行容器体积减小,平衡向正反应方向移动,故放出较多热量.
| A. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-725.8kJ•mol-1 | |
| B. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+1451.6kJ•mol-1 | |
| C. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-22.68kJ•mol-1 | |
| D. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g);△H=-725.8kJ•mol-1 |
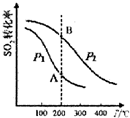 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0
SO2的平衡转化率与温度、压强的关系如图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
能说明该反应达到化学平衡状态的是d(填序号).
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O=2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.