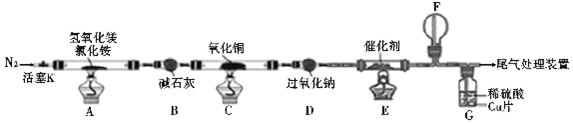
题目内容
1.配制一定物质的量浓度的NaOH溶液时,下列因素会导致溶液浓度偏高的是( )| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |
分析 结合c=$\frac{n}{V}$可知,不当操作导致n偏大或V偏小,均会导致溶液浓度偏高,以此来解答.
解答 解:A.溶解时有少量液体溅出,n偏小,则导致溶液浓度偏低,故A不选;
B.洗涤液未全部转移到容量瓶中,n偏小,则导致溶液浓度偏低,故B不选;
C.容量瓶使用前未干燥,对n、V无影响,浓度不变,故C不选;
D.定容时液面未到刻度线,V偏小,导致溶液浓度偏高,故D选;
故选D.
点评 本题考查一定物质的量浓度溶液的配制,为高频考点,把握步骤、操作及误差分析为解答的关键,侧重分析与实验能力的考查,注意结合公式分析误差,题目难度不大.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
11.Al(OH)3 是一种常用的阻燃剂,添加在可燃物中的 Al(OH)3 受热分解的化学反应如下:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,其阻燃原因之一是此过程可以降温到可燃物的着火点以下.该反应属于( )
| A. | 离子反应 | B. | 吸热反应 | C. | 复分解反应 | D. | 氧化还原反应 |
9.2SO2(g)+O2(g)$?_{△}^{V_{2}O_{5}}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2(c1<c2),则时间间隔为 t1~t2内(t1<t2,以秒为单位),SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1 |
16.下列关于有机物的说法不正确的是( )
| A. | 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体 | |
| B. | 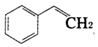 中所有原子可能共平面 中所有原子可能共平面 | |
| C. | 1 mol苹果酸(HOOCCHOHCH2COOH)可与3mol NaHCO3发生反应 | |
| D. | -C3H7和-C2H5O各取代苯分子中的一个氢原子形成的二元取代物的同分异构体有24种 |
13.应用元素周期律的有关知识进行的下列预测中,正确的是( )
①Be的最高价氧化物对应的水化物具有两性
②Tl(铊)与盐酸和NaOH溶液作用均能产生氢气
③At的单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧的产物为Li2O2
⑤SrSO4(硫酸锶)是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体.
①Be的最高价氧化物对应的水化物具有两性
②Tl(铊)与盐酸和NaOH溶液作用均能产生氢气
③At的单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧的产物为Li2O2
⑤SrSO4(硫酸锶)是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体.
| A. | ①③⑤ | B. | ②④⑥ | C. | ③④⑥ | D. | ①②③ |
10.下列说法不正确的是( )
| A. | CH3CH=CHCH3,分子中的四个碳原子在同一直线上 | |
| B. | 乙醛能使溴水出现褪色觋象,是因为乙醛发生了氧化反应 | |
| C. | 在酸性条件下,CH3CO18OCH2CH3的水解产物是CH3COOH和CH3CH218OH | |
| D. | 聚合物(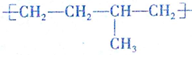 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
 ,棕黄色
,棕黄色 .
.