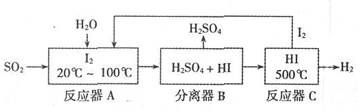
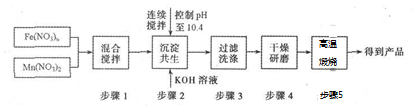
题目内容
11.Al(OH)3 是一种常用的阻燃剂,添加在可燃物中的 Al(OH)3 受热分解的化学反应如下:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,其阻燃原因之一是此过程可以降温到可燃物的着火点以下.该反应属于( )| A. | 离子反应 | B. | 吸热反应 | C. | 复分解反应 | D. | 氧化还原反应 |
分析 A.离子反应指有离子参加的化学反应;
B.常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
C.复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应;
D.氧化还原反应的特征是有化合价的升降;
解答 解:A.该反应无离子参加,故A错误;
B.Al(OH)3分解反应属于吸热反应,故B正确;
C.该反应不是相互交换成分的反应,故不是复分解反应,故C错误;
D.该反应无化合价升降,属于非氧化还原反应,故D错误;
故选B.
点评 本题考查化学基本反应类型,题目难度不大,注意把握离子反应以及氧化还原反应的实质.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
2.已知某溶液中存在NH4+、Ba2+、Fe3+三种阳离子,则其中可能大量存在的阴离子是( )
| A. | SCN- | B. | CO32- | C. | Cl- | D. | OH- |
19.A、B、C、D、E五种元素为同周期从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下:下列说法中正确的是( )
| A | B | C | D | E |
| A. | HnDOm为强酸时,E的非金属性一定很强 | |
| B. | A(OH)n为强碱时,B(OH)m也一定为强碱 | |
| C. | E元素的最高化合价为+7时,D元素的负化合价可为-2价 | |
| D. | HnCOm为强酸时,E的单质可能有强还原性 |
6.下列反应既属于非氧化还原反应,又属于吸热反应的是( )
| A. | 高温下炭与CO2的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 生石灰溶于水的反应 | D. | 盐酸与烧碱溶液的中和反应 |
16.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 同主族元素性质的相似性 | 钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 较强酸可以制取较弱酸 | 亚硫酸和次氯酸钙反应可以制取次氯酸 |
| A. | A | B. | B | C. | C | D. | D |
3.下列有关有机物的说法正确的是( )
| A. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| B. | 利用减压过滤的方法可以用来快速分离、提纯蛋白质 | |
| C. | 苯与溴水混合,反复振荡后溴水层褪色,这是由于发生了取代反应 | |
| D. | 邻二甲苯只有一种结构,证明苯环中不存在碳碳单键和碳碳双键交替的结构 |
20.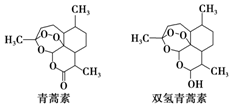 中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
 中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素通过还原反应可制得双氢青蒿素 | |
| C. | 青蒿素有青蒿的芳香气味,是芳香族化合物 | |
| D. | 用有机溶剂乙醚从青蒿中提取青蒿素,主要采用萃取的方法 |
1.配制一定物质的量浓度的NaOH溶液时,下列因素会导致溶液浓度偏高的是( )
| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |