题目内容
9.2SO2(g)+O2(g)$?_{△}^{V_{2}O_{5}}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2(c1<c2),则时间间隔为 t1~t2内(t1<t2,以秒为单位),SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1 |
分析 A.根据催化剂可以同等程度的增大正逆反应的反应速率;
B.增加压强不一定能增加反应速率,必须是提高反应物浓度(例如压缩体积),像充入惰性气体这样的方式,虽然增加了压强,但是反应速度依然不变;
C.降低温度反应速率减小;
D.根据v=$\frac{△c}{△t}$计算判断.
解答 解:A、催化剂可同等程度的改变正、逆反应的反应速率,故A错误;
B、若在恒容条件下,向容器通入惰性气体,反应体系的压强变大,但反应各物质的浓度不变,因此反应速率也不变,故B错误;
C、不论反应是吸热反应还是放热反应,降低温度反应速率一定变慢,则达到平衡的时间将延长,故C错误;
D、根据计算平均速率的定义公式,浓度变化量c2-c1,时间为t2-t1,SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1,故D正确;
故选:D.
点评 本题主要考查化学反应速率与化学平衡的影响的因素,化学反应速率计算等,B选项为易错点,注意理解压强对反应速率、化学平衡的影响,改变压强影响物质的浓度.

练习册系列答案
相关题目
19.A、B、C、D、E五种元素为同周期从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下:下列说法中正确的是( )
| A | B | C | D | E |
| A. | HnDOm为强酸时,E的非金属性一定很强 | |
| B. | A(OH)n为强碱时,B(OH)m也一定为强碱 | |
| C. | E元素的最高化合价为+7时,D元素的负化合价可为-2价 | |
| D. | HnCOm为强酸时,E的单质可能有强还原性 |
20.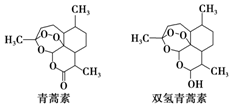 中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
 中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
中国科学家屠呦呦因创制新型抗疟药--青蒿素和双氢青蒿素获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素通过还原反应可制得双氢青蒿素 | |
| C. | 青蒿素有青蒿的芳香气味,是芳香族化合物 | |
| D. | 用有机溶剂乙醚从青蒿中提取青蒿素,主要采用萃取的方法 |
17.一定条件下N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol,用1.5molN2和一定量H2反应时,当N2的转化率为80%,达到平衡状态,放出的热量为( )
| A. | 136.8kJ | B. | 110.9kJ | C. | 83.2kJ | D. | 82.4kJ |
1.配制一定物质的量浓度的NaOH溶液时,下列因素会导致溶液浓度偏高的是( )
| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |
18.四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素X在周期表中的位置为第二周期IVA族.
(2)最高价氧化物对应的水化物的浓溶液与其氢化物能发生氧化还原反应的元素是S(写元素符号).
(3)XW2的电子式为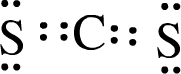 .
.
(4)Z 的最高价氧化物对应的水化物的化学式为H3PO4.
(5)W 和Y形成的一种二元化合物具有色温效应,其相对分子质量在170-190之间,且W的质量分数约为70%,该化合物的化学式为S4N4.
| X | Y | |
| Z | W |
(1)元素X在周期表中的位置为第二周期IVA族.
(2)最高价氧化物对应的水化物的浓溶液与其氢化物能发生氧化还原反应的元素是S(写元素符号).
(3)XW2的电子式为
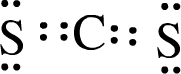 .
.(4)Z 的最高价氧化物对应的水化物的化学式为H3PO4.
(5)W 和Y形成的一种二元化合物具有色温效应,其相对分子质量在170-190之间,且W的质量分数约为70%,该化合物的化学式为S4N4.
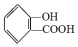 ,
,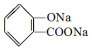 ;请写出将
;请写出将 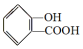 转化为
转化为 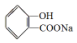 的化学方程式
的化学方程式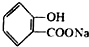 +H2O+CO2↑.
+H2O+CO2↑.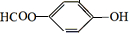
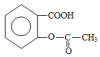 ,它与足量氢氧化钠溶液发生反应的方程式是
,它与足量氢氧化钠溶液发生反应的方程式是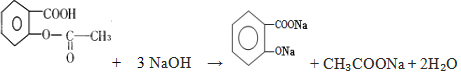 .
.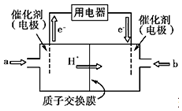 氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)
氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)