题目内容
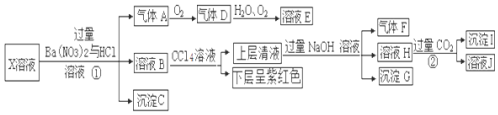
6.碱式氯化镁( MgOHCl)常用于塑料添加剂,工业上制备方法较多,其中利用氢氧化镁和氯化铵混合加热生成氨气并得到碱式氯化镁的工艺属于我国首创.某科研小组同学根据该原理设计了如图实验装置来制备碱式氯化镁并探究氨的部分化学性质,其中CuO的质量为8.0g.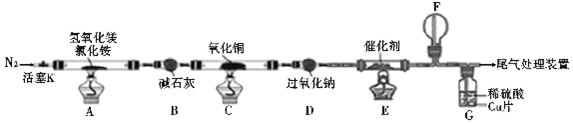
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)D装置中 Na2O2的作用是与水反应为探究氨的催化氧化提供O2.
(3)一段时间后,装置 F中可观察到的现象是生成红棕色气体.
(4)反应完毕,装置C中的8.0g 氧化铜完全反应,由黑色变为红色,称得残余固体的质量为6.8g,且生成的气体可直接排放到大气中,写出该反应的化学方程式4CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+Cu2O+N2+3H2O;该反应中电子转移的物质的量为0.15 mol.
(5)反应完毕,测得装置G中Cu片和稀硫酸均有剩余,则反应后装置G中还含有的主要溶质是硫酸铜 (填名称).
(6)实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH-----2NaNO2+H2O.设计实验验证产物NaNO2 既有氧化性又有还原性.限选试剂:稀硫酸、KI淀粉溶液、双氧水、酸性 KMnO4溶液
①取适量NaNO2 溶液,加人稀硫酸、KI-淀粉溶液,观察到溶液变成蓝色,证明其具有氧化性.
②设计实验证明NaNO2 有还原性.
分析 A中反应得到MgOHCl,还生成NH3与H2O,碱石灰干燥氨气,C中氨气与氧化铜反应会得到氮气与水,D中过氧化钠水反应生成氧气,E中氨气与氧气发生催化氧化,F中NO与氧气反应得到二氧化氮,G中二氧化氮溶解得到硝酸,硝酸与Cu反应.
(1)氢氧化镁与氯化铵再加热条件下反应生成MgOHCl、NH3与H2O,据此书写方程式;
(2)D中过氧化钠水反应生成氧气,为E中氨气与氧气反应提供氧气;
(3)二氧化氮为红棕色气体,F中NO与氧气反应生成二氧化氮;
(4)固体质量减少质量为减少的氧元素质量,再计算CuO中氧元素质量,可以判断红色固体的组成,红色物质为Cu或Cu2O或二者混合物,根据原子守恒和得失电子守恒书写方程式,根据Cu元素守恒、红色固体总质量计算组成物质的量,进而计算转移电子;
(5)G中二氧化氮溶解得到硝酸,硝酸与Cu反应,稀硫酸有剩余,根据原子守恒可知反应后装置G中还含有的主要溶质是硫酸铜;
(6)①说明 NO2-有氧化性,则N元素的化合价降低,在酸性条件下,与还原剂KI反应即可;
②说明 NO2-有还原性,则N元素的化合价升高,与氧化剂KMnO4反应即可.
解答 解:(1)氢氧化镁与氯化铵再加热条件下反应生成MgOHCl、NH3与H2O,反应方程式为:Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O,
故答案为:Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O;
(2)E中氨气与氧气发生催化氧化,需反应物氧气,D中过氧化钠水反应2Na2O2+2H2O=4NaOH+O2↑,生成氧气,为探究氨的催化氧化提供O2,
故答案为:与水反应为探究氨的催化氧化提供O2;
(3)F中NO与氧气反应生成红棕色的二氧化氮气体,所以一段时间后,装置 F中观察到的现象为生成红棕色气体,
故答案为:生成红棕色气体;
(4)固体质量减少质量为减少的氧元素质量,则减少的氧元素质量为8g-6.8g=1.2g,而CuO中氧元素质量为8.0g×$\frac{16}{80}$=1.6g>1.2g,故红色固体为Cu、Cu2O混合物,生成的气体可直接排放到大气中,为氮气,所以反应方程式为:4CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+Cu2O+N2+3H2O,设Cu、Cu2O二者物质的量分别为xmol、ymol,则:x+2y=$\frac{8}{80}$(铜元素守恒),64x+144y=6.8(质量守恒)解得x=0.05mol,y=0.025mol,则转移电子为0.05mol×2+0.025mol×2=0.15mol,
故答案为:4CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+Cu2O+N2+3H2O;0.15;
(5)铜在硫酸中不溶解,但在硝酸中溶解,G中二氧化氮溶解得到硝酸,硝酸与Cu反应,因稀硫酸有剩余,根据原子守恒可知反应后装置G中还含有的主要溶质是硫酸铜,
故答案为:硫酸铜;
(6)①碘单质与淀粉作用显示蓝色,说明 NO2-有氧化性,则N元素的化合价降低,在酸性条件下,与还原剂KI反应,所以选择的试剂为KI-淀粉溶液、稀硫酸,观察到现象溶液变蓝,证明其具有氧化性,故答案为:KI-淀粉溶液;
②说明 NO2-有还原性,则N元素的化合价升高,与氧化剂KMnO4反应,验证方法为:取适量NaNO2溶液,滴加少许酸性KMnO4溶液,观察到溶液褪色,证明其具有还原性,故答案为:取适量NaNO2溶液,滴入几滴酸性KMnO4溶液,观察到溶液褪色,证明其具有还原性.
点评 本题考查物质的制备及性质探究实验,关键是理解各装置作用,熟练掌握元素化合物性质,(4)中注意利用氧元素质量变化判断固体组成,也可以利用Cu元素质量确定,(6)中充分利用题目信息进行实验设计,题目难度中等.

 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| 选项 | 规律 | 结论 |
| A | 同主族元素性质的相似性 | 钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 较强酸可以制取较弱酸 | 亚硫酸和次氯酸钙反应可以制取次氯酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 136.8kJ | B. | 110.9kJ | C. | 83.2kJ | D. | 82.4kJ |
| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |
| A. | 是氢元素的五种核素 | |
| B. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2互称为同素异形体 | |
| C. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H互称为同位素 | |
| D. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H的化学性质不同 |
| X | Y | |
| Z | W |
(1)元素X在周期表中的位置为第二周期IVA族.
(2)最高价氧化物对应的水化物的浓溶液与其氢化物能发生氧化还原反应的元素是S(写元素符号).
(3)XW2的电子式为
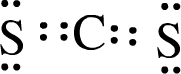 .
.(4)Z 的最高价氧化物对应的水化物的化学式为H3PO4.
(5)W 和Y形成的一种二元化合物具有色温效应,其相对分子质量在170-190之间,且W的质量分数约为70%,该化合物的化学式为S4N4.
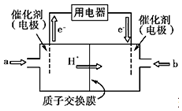 氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过)
氢氧燃料电池的结构示意图如图所示,一极通入氢气,另外一极通入氧气;电解质溶液是稀硫酸.(图中:质子交换膜只允许H+通过) 和
和