题目内容
13.应用元素周期律的有关知识进行的下列预测中,正确的是( )①Be的最高价氧化物对应的水化物具有两性
②Tl(铊)与盐酸和NaOH溶液作用均能产生氢气
③At的单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧的产物为Li2O2
⑤SrSO4(硫酸锶)是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体.
| A. | ①③⑤ | B. | ②④⑥ | C. | ③④⑥ | D. | ①②③ |
分析 ①元素周期表中的对角线规则:处于对角线的元素具有相似性;
②同主族元素性质具有相似性和递变性;
③卤素单质都是有色物质,且随着原子序数增大其单质颜色加深,AgX中只有AgF易溶于水,其它卤化银既不属于水也不溶于稀硝酸;
④Li燃烧生成的是Li2O;
⑤同主族元素化合物的性质具有相似性和递变性;
⑥元素的非金属性越强,其氢化物的稳定性越强.
解答 解:①元素周期表中Be和Al处于对角线位置上,处于对角线的元素具有相似性,所以Be的最高价氧化物对应的水化物可能具有两性,故①正确;
②铊(Tl)与铝同主族,其单质能与盐酸反应,由于铊比铝活泼没有两性,所以不能与氢氧化钠反应,故②错误;
③卤素单质都是有色物质,且随着原子序数增大其单质颜色加深,AgX中只有AgF易溶于水,其它卤化银既不属于水也不溶于稀硝酸,所以卤族元素At的单质为有色固体,AgAt可能不溶于水也不溶于稀硝酸,故③正确;
④Li的活泼性小于Na,Li在氧气中燃烧生成Li2O,不会生成Li2O2,故④错误;
⑤第ⅡA元素硫酸盐性质的递变规律,硫酸钡(BaSO4)是难溶于水的白色固体,则硫酸锶(SrSO4)是难溶于水的白色固体,故⑤正确;
⑥非金属性越强,气态氢化物越稳定,非金属性:S>Se,则氢化物稳定性为:H2S>H2Se,故⑥错误;
所以正确的为:①③⑤,
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,题目难度中等,明确同一周期、同一主族元素性质递变规律是解本题关键,注意掌握原子结构与元素周期律、元素周期表的关系.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
3.下列有关有机物的说法正确的是( )
| A. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| B. | 利用减压过滤的方法可以用来快速分离、提纯蛋白质 | |
| C. | 苯与溴水混合,反复振荡后溴水层褪色,这是由于发生了取代反应 | |
| D. | 邻二甲苯只有一种结构,证明苯环中不存在碳碳单键和碳碳双键交替的结构 |
1.配制一定物质的量浓度的NaOH溶液时,下列因素会导致溶液浓度偏高的是( )
| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |
8.手性碳原子存在于很多有机化合物中,人们将连有四个不同基团的碳原子形象地成为手性碳原子.下列化合物中含有2个手性碳原子的是( )
| A. |  | B. |  | C. | CH3CH2COOH | D. |  |
18.四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素X在周期表中的位置为第二周期IVA族.
(2)最高价氧化物对应的水化物的浓溶液与其氢化物能发生氧化还原反应的元素是S(写元素符号).
(3)XW2的电子式为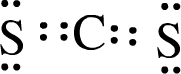 .
.
(4)Z 的最高价氧化物对应的水化物的化学式为H3PO4.
(5)W 和Y形成的一种二元化合物具有色温效应,其相对分子质量在170-190之间,且W的质量分数约为70%,该化合物的化学式为S4N4.
| X | Y | |
| Z | W |
(1)元素X在周期表中的位置为第二周期IVA族.
(2)最高价氧化物对应的水化物的浓溶液与其氢化物能发生氧化还原反应的元素是S(写元素符号).
(3)XW2的电子式为
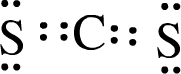 .
.(4)Z 的最高价氧化物对应的水化物的化学式为H3PO4.
(5)W 和Y形成的一种二元化合物具有色温效应,其相对分子质量在170-190之间,且W的质量分数约为70%,该化合物的化学式为S4N4.
5.如图是某有机物分子的比例模型,有关该物质的推断不正确的是( )


| A. | 该有机物的分子式为C3H6O3 | B. | 该有机物分子中含有羟基和羧基 | ||
| C. | 该有机物可以发生消去反应 | D. | 该有机物可以发生加成反应 |
2.下列叙述中错误的是( )
| A. | 苯与浓硫酸、浓硝酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 甲苯与氯气在光照的条件下反应主要生成2,4-二氯甲苯 | |
| C. | 苯酚与浓溴水反应生成2,4,6-三溴苯酚 | |
| D. | 丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷 |
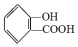 ,
,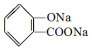 ;请写出将
;请写出将 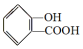 转化为
转化为 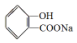 的化学方程式
的化学方程式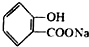 +H2O+CO2↑.
+H2O+CO2↑.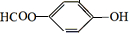
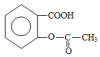 ,它与足量氢氧化钠溶液发生反应的方程式是
,它与足量氢氧化钠溶液发生反应的方程式是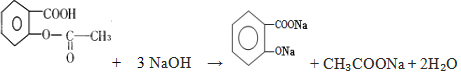 .
.