题目内容
1.碘及其化合物在生活中应用广泛.含有碘离子的溶液需回收处理.(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列两个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)=$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(aq)△H2
①反应:SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)的△H=△H1+2△H2(用△H1、△H2表示).
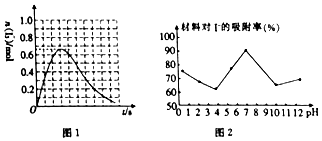
②反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)?I3-(aq),其反应速率极快且平衡常数大.现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应.溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示.开始阶段.N(I3-)逐渐增大的原因是开始阶段,SO2和I2反应生成的I-的浓度不断增大,I2(aq)+I-(aq)?I3-(aq)的反应平衡向右移动,n(I3-)不断增加.
(2)用海带提取碘时,需用氯气将碘离子氧化成单质.酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子,写出氯气与碘单质反应的离子方程式:5Cl2+I2+7H2O=2IO3-+10Cl-+12H+.
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究.如图2是不同PH条件下,碘离子吸附效果的变化曲线.据此推断Ag/TiO2材料最适合吸附中性 (填“酸性”“中性”或“碱性”)溶液中的I-.
(4)氯化银复合吸附剂也可有效吸附碘离子.氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
?AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=$\frac{c(C{l}^{-})Kap(AgI)}{Kap(AgCl)}$[用c(Cl-)、Kap(AgCl)和Kaq(AgI)表示].该方法去除碘离子的原理是AgI的溶度积比AgCl的溶度积小.
分析 (1)①SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)①△H1
HI(aq)=$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(aq)②△H2,①+2×②得,SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)△H=△H1+2△H2,据此进行分析;
②开始阶段,SO2和I2反应生成的I-的浓度不断增大,I2(aq)+I-(aq)?I3-(aq)的反应平衡向右移动,n(I3-)不断增加;
(2)据题意书写离子方程式;
(3)据图象分析pH=7时,吸附效果最好;
(4)Kap(AgCl)=c(Ag+)c(Cl-),则c(Ag+)=$\frac{Kap(AgCl)}{c(C{l}^{-})}$,Kaq(AgI)=c(Ag+)c(I-),则c(Ag+)=$\frac{Kaq(AgI)}{c({I}^{-})}$,故$\frac{Kap(AgCl)}{c(C{l}^{-})}$=$\frac{Kaq(AgI)}{c({I}^{-})}$,据此进行计算; AgI的溶度积比AgCl的溶度积小.
解答 解:(1)①SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)①△H1
HI(aq)=$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(aq)②△H2,①+2×②得,SO2(g)+2H2O(1)═H2SO4(aq)+H2(g)△H=△H1+2△H2,
故答案为:△H1+2△H2;
②N(I3-)逐渐增大的原因是,开始阶段,SO2和I2反应生成的I-的浓度不断增大,I2(aq)+I-(aq)?I3-(aq)的反应平衡向右移动,n(I3-)不断增加,
故答案为:开始阶段,SO2和I2反应生成的I-的浓度不断增大,I2(aq)+I-(aq)?I3-(aq)的反应平衡向右移动,n(I3-)不断增加;
(2)氯气过量就能将碘单质进一步氧化成碘酸根离子,故氯气与碘单质反应的离子方程式为5Cl2+I2+7H2O=2IO3-+10Cl-+12H+,
故答案为:5Cl2+I2+7H2O=2IO3-+10Cl-+12H+;
(3)据图象分析pH=7时,吸附效果最好,故最适合吸附的是中性,
故答案为:中性;
(4)Kap(AgCl)=c(Ag+)c(Cl-),则c(Ag+)=$\frac{Kap(AgCl)}{c(C{l}^{-})}$,Kaq(AgI)=c(Ag+)c(I-),则c(Ag+)=$\frac{Kaq(AgI)}{c({I}^{-})}$,故$\frac{Kap(AgCl)}{c(C{l}^{-})}$=$\frac{Kaq(AgI)}{c({I}^{-})}$,故c(I-)=$\frac{c(C{l}^{-})Kap(AgI)}{Kap(AgCl)}$,该方法去除碘离子的原理是利用AgI的溶度积比AgCl的溶度积小;
故答案为:$\frac{c(C{l}^{-})Kap(AgI)}{Kap(AgCl)}$;AgI的溶度积比AgCl的溶度积小.
点评 本题考查反应热的计算,离子方程式的书写,据图象分析吸附效果,离子浓度的计算,本题难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |
| A. | 苯与浓硫酸、浓硝酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 甲苯与氯气在光照的条件下反应主要生成2,4-二氯甲苯 | |
| C. | 苯酚与浓溴水反应生成2,4,6-三溴苯酚 | |
| D. | 丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷 |
| A. | ⑤⑥ | B. | ②④⑦ | C. | ①⑥ | D. | ⑤⑥⑦ |
| A. | 随原子序数递增,元素原子的最外层电子排布呈现周期性变化 | |
| B. | 随原子序数递增,元素的原子半径呈现由大到小的周期性变化(惰性气体除外) | |
| C. | 随原子序数递增,元素的最高化合价重复出现从+1〜+7、最低化合价从-7〜-1的变化 | |
| D. | 随原子序数递增,元素的金属性和非金属性呈现周期性变化 |
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中必含离子键 | D. | 共价化合物中不含离子键 |