题目内容
5.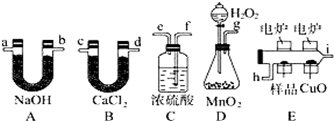 化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置.
化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置.完成下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a);
(2)C装置中浓硫酸的作用是吸收水分,制备干燥纯净的氧气;
(3)D装置中发生反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)准确称取1.8g烃的含氧衍生物X的样品,经充分燃烧后,A管质量增加2.64g,B管质量增加1.08g,则该有机物的实验式是CH2O.实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为C3H6O3,1mol X分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,X可能的结构简式为HOCH2CH2COOH、CH3CH(OH)COOH(写出一种即可).
分析 实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,D用于制备氧气、C为干燥装置、D是在电炉加热时用纯氧气氧化管内样品,根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,B用于吸收水,A吸收二氧化碳,确定物质的化学式可借助元素的质量守恒进行解答,以此解答该题.
解答 解:实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,D用于制备氧气、C为干燥装置、D是在电炉加热时用纯氧气氧化管内样品,根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,B用于吸收水,A吸收二氧化碳,确定物质的化学式可借助元素的质量守恒进行解答.
(1)根据分析,产生的氧气从左到右流向,装置的连接顺序是DCEBA,其中浓硫酸的导管应长进短出,则连接顺序是g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a),
故答案为:g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a);
(2)C装置的作用是干燥,吸收水分,制备干燥纯净的氧气,
故答案为:吸收水分,制备干燥纯净的氧气;
(3)D中是双氧水在二氧化锰作用下分解产生氧气,反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)D管质量增加2.64g克说明生成了2.64g,n(CO2)=$\frac{2.64g}{44g/mol}$=0.06mol,m(C)=0.06mol×12g/mol=0.72g;
E管质量增加1.08g,说明生成了1.08g的水,n(H2O)=$\frac{1.08g}{18g/mol}$=0.06mol,m(H)=0.06mol×2×1g/mol=0.12g;
从而可推出含氧元素的质量为:1.8g-0.72g-0.12g=0.96g,n(O)=$\frac{0.96g}{16g/mol}$=0.06mol,
N(C):N(H):N(O)=0.06mol:0.12mol:0.06mol=1:2:1,
故该有机物的实验式为CH2O,式量为30,
该有机物的相对分子质量为:45×2=90,设分子式为 CnH2nOn,30n=90,解得n=3,故分子式为:C3H6O3;
因 1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,则含一个羟基和一个羧基,
故该有机物结构简式为:HOCH2CH2COOH、CH3CH(OH)COOH;
故答案为:CH2O;C3H6O3;HOCH2CH2COOH、CH3CH(OH)COOH.
点评 本题有机物的推断、物质的分子的测定,侧重于学生的分析、实验和计算能力的考查,为高频考点,题目有利于培养学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

| A. | NaOH | B. | Na2CO3•10H2O | C. | 无水CaCl2 | D. | Na 2O2 |
| A. | 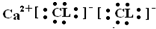 | |
| B. | C1-的结构示意图: | |
| C. | ${\;}_{46}^{102}$Pd和${\;}_{46}^{103}$Pd互为同位素 | |
| D. | 过氧化氢电子式: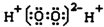 |
| A. | C物质的生成速率和A的生成速率相等 | |
| B. | 容器内气体的压强不再随时间而改变 | |
| C. | 单位时间内生成a mol物质A,同时生成3a mol物质B | |
| D. | A、B、C三种物质的分子数之比为1:3:2 |
| A. | 总反应为NO+NO2+O2+H2O═2HNO3 | |
| B. | 总反应为2NO+10NO2+4O2+6H2O═12HNO3 | |
| C. | 生成硝酸的物质的量浓度接近0.03 mol/L | |
| D. | 生成硝酸的物质的量浓度约为0.045 mol/L |
| A. | 都是金属元素 | B. | 原子半径相差不大 | ||
| C. | 最外层电子数相同 | D. | 化合价相同 |

| A. | a极是负极 | B. | 供电时的总反应为2H2+O2═2H2O | ||
| C. | 电子由b通过灯泡流向a | D. | 氢氧燃料电池是环保电池 |
| A. | 1 mol C10H22分子中氢原子数为22NA | |
| B. | 6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 | |
| C. | 32g氧气所含的原子数目为2×6.02×1023 | |
| D. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L |