题目内容
14.下列说法中不正确的是( )| A. | 1 mol C10H22分子中氢原子数为22NA | |
| B. | 6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 | |
| C. | 32g氧气所含的原子数目为2×6.02×1023 | |
| D. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L |
分析 A.1 mol C10H22分子中含有22molH;
B.等物质的量的分子,质量比等于摩尔质量之比;
C.根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算;
D.常温下气体摩尔体积不等于22.4L/mol.
解答 解:A.1 mol C10H22分子中含有22molH,则氢原子数为22NA,故A正确;
B.6.02×1023个氮分子和6.02×1023个氢分子的物质的量相同,等物质的量的分子,质量比等于摩尔质量之比,为14:1,故B正确;
C.32g氧气的n=$\frac{m}{M}$=1mol,所含的原子数目为2×6.02×1023,故C正确;
D.常温下气体摩尔体积不等于22.4L/mo,则常温常压下,0.5×6.02×1023个一氧化碳分子所占体积不等于11.2L,故D错误.
故选D.
点评 本题综合考查物质的量的计算,侧重于学生的计算能力的考查,注意把握相关计算公式列式解答该题,易错点为D,注意气体存在的条件,难度不大.

练习册系列答案
相关题目
4.微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电池总反应式为Ag2O+Zn═2Ag+ZnO.根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液pH增大 | |
| B. | 在使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | 在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 | |
| D. | 外电路中每通过0.2 mol电子,正极的质量理论上减小1.6 g |
2.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 由金属A和金属B构成的原电池,电子由A流向B | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | 常温时,A能从酸中置换出氢,而B不能 |
9.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有氢气放出,下列叙述不正确的是( )
| A. | NH4H是离子化合物,含有离子键和共价键 | |
| B. | NH4H与水反应时,NH4H是还原剂 | |
| C. | 每反应1molNH4H,转移2mol电子 | |
| D. | NH4H投入少量的水中,有两种气体产生 |
19.下列化学用语或模型表示正确的是( )
| A. | H2O2分子结构式:H-O-O-H | B. | 氚原子符号:${\;}_{1}^{2}$H | ||
| C. | Mg2+结构示意图: | D. | CO2的电子式: |
6.下列叙述不正确的是( )
| A. | 在干旱地区植树造林时,可利用高吸水性树脂抗旱保水 | |
| B. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶的原料 | |
| C. | SiO2的导电能力强,可用于制造太阳能电池板 | |
| D. | 服用阿司匹林若出现水杨酸反应,应立即停药并静脉滴注NaHCO3溶液. |
16.科学家预言,燃料电池将是21 世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许H+和水分子通过.其工作原理的示意图如下.下列说法错误的是( )
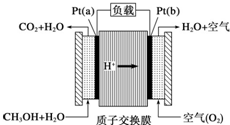

| A. | a 是负极,b 是正极 | |
| B. | b 极的电极反应是O2+4H++4e-=2H2O | |
| C. | 放电过程中,电子流动方向为:a→b→质子交换膜→a | |
| D. | 当电路上通过2 mol 电子消耗的CH3OH 为1/3mol |
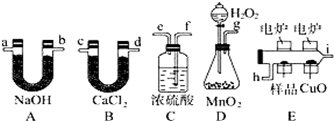 化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置.
化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置.