题目内容
9.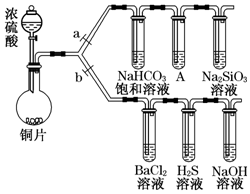 根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).
根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).(1)验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸).
①连接仪器、检查装置的气密性、加药品后,打开a、关闭b,然后滴入浓硫酸,加热.
②铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
装置A中试剂是为了除去多余的SO2,该试剂是酸性KMnO4溶液.
③能说明碳的非金属性比硅强的实验现象是A中酸性KMnO4溶液没有完全退色(或不褪色),盛有Na2SiO3溶液的试管中出现白色沉淀.
(2)验证SO2的氧化性、还原性和酸性氧化物的通性.
①在(1)①操作后打开b,关闭a.
②H2S溶液中有浅黄色浑浊出现,化学方程式是2H2S+SO2═3S↓+2H2O.体现SO2的氧化性.
③BaCl2溶液中无明显现象,将其分成两份,其中一份滴加足量的NaOH溶液,生成BaSO3沉淀(填化学式).另一份中滴加新制氯水,写出发生反应生成沉淀的离子方程式Cl2+SO2+2H2O+Ba2+═BaSO4↓+4H++2Cl-.
分析 (1)①反应生成气体,在加入药品之前需要检验装置的气密性;
②在加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,据此写出反应方程式;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验;
③二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,需要先除去二氧化硫;
(2)②、H2S溶液中二氧化硫与硫化氢反应生成硫单质与水;
③反应后的BaCl2溶液中含有亚硫酸,加入氢氧化钠溶液反应生成亚硫酸钠会和氯化钡结合生成亚硫酸钡白色沉淀,亚硫酸被氯水氧化物硫酸,据此解答.
解答 解:(1)①反应生成气体,在加入药品之前需要检验装置的气密性,防止气密性不好导致气体泄漏,
故答案为:检查装置的气密性;
②加热条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;多余的二氧化硫用酸性KMnO4溶液吸收,防止干扰后面的试验,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;酸性KMnO4溶液;
③二氧化硫也会和硅酸钠溶液反应,需要用高锰酸钾溶液除去,二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,所以A中酸性KMnO4溶液没有完全退色(或不褪色),盛有Na2SiO3溶液的试管中出现白色沉淀即说明碳元素的非金属性比硅元素非金属性强,
故答案为:A中酸性KMnO4溶液没有完全退色(或不褪色),盛有Na2SiO3溶液的试管中出现白色沉淀;
(2)②、H2S溶液中二氧化硫与硫化氢反应生成硫单质与水,反应离子方程式为:2H2S+SO2=3S↓+2H2O,反应中二氧化硫具有氧化性,
故答案为:2H2S+SO2=3S↓+2H2O;氧化;
③反应后的BaCl2溶液中含有亚硫酸,亚硫酸被氯水氧化物硫酸,硫酸与氯化钡反应生成硫酸钡,亚硫酸与氢氧化钠溶液反应生成亚硫酸钠,亚硫酸钠与氯化钡反应生成硫酸钡,故都产生白色沉淀,滴加足量的NaOH溶液,生成白色沉淀为BaSO3,滴加新制氯水发生反应生成沉淀的离子方程式:Cl2+SO2+2H2O+Ba2+═BaSO4↓+4H++2Cl-,
故答案为:BaSO3,Cl2+SO2+2H2O+Ba2+═BaSO4↓+4H++2Cl-.
点评 本题考查了非金属性的相对强弱的探究实验,涉及仪器名称,化学方程式的书写,离子方程式的书写,判断非金属性强弱的依据等 考查的知识点较多,难度中等.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 酸性强弱HIO4<HBrO4<HClO4 | B. | 原子半径大小S>Na>O | ||
| C. | 碱性强弱KOH<NaOH<LiOH | D. | 金属性强弱Na<Mg<Al |
| A. | 标准状况下,由H2O2制得2.24L O2转移的电子数为0.4NA | |
| B. | 精炼铜,若阳极失去2NA个电子,则阴极增重64g | |
| C. | NO2和H2O反应生成2mol HNO3时转移的电子数为4NA | |
| D. | 常温常压下,11.2L NH3中所含氮原子数为0.5NA |
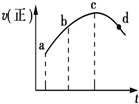 将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将b g(a>b)粉末状碳酸钙与同浓度的足量盐酸反应(图中虚线所示),则相应的曲线正确的是( )
将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将b g(a>b)粉末状碳酸钙与同浓度的足量盐酸反应(图中虚线所示),则相应的曲线正确的是( )| A. | 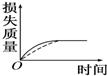 | B. | 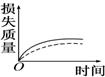 | C. | 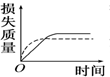 | D. | 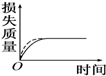 |
| 实验 序号 | 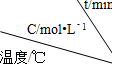 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1 中,反应在10min~20min 内A平均速率为0.03 mol/(L•min)
(2)在实验 2 中,A 的初始浓度 C2为2.0 mol/L,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且C3> 2.0mol/L (填<、>或=)
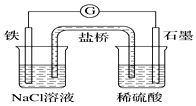
| A. | 石墨电极上发生氧化反应 | B. | 负极反应:2H++2e-═H2↑ | ||
| C. | 电流方向:石墨→铁 | D. | 盐桥中Cl-向右池移动 |