题目内容
4.某化学反应 3A?2B+D在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如表:| 实验 序号 | 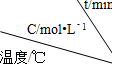 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1 中,反应在10min~20min 内A平均速率为0.03 mol/(L•min)
(2)在实验 2 中,A 的初始浓度 C2为2.0 mol/L,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且C3> 2.0mol/L (填<、>或=)
分析 (1)实验 1,反应在10min~20min 内A的浓度减少1.6mol/L-1.3mol/L=0.3mol/L,结合v=$\frac{△c}{△t}$计算;
(2)实验1、2的温度相同,平衡浓度相同,则起始量相同,2中达到平衡的时间少,反应速率快;
(3)实验1、3比较,温度相同,3中平衡浓度大,可知实验3中开始浓度大,浓度越大反应速率越快.
解答 解:(1)实验 1,反应在10min~20min 内A的浓度减少1.6mol/L-1.3mol/L=0.3mol/L,10min~20min 内用A的浓度变化表示的平均速率为$\frac{0.3mol/L}{10min}$=0.03 mol/(L•min),故答案为:0.03;
(2)实验1、2的温度相同,平衡浓度相同,则起始量相同,A 的初始浓度 c2为2.0mol/L,2中达到平衡的时间少,反应速率快,则实验 2 中还隐含的条件是使用催化剂,
故答案为:2.0;使用催化剂;
(3)实验1、3比较,温度相同,3中平衡浓度大,可知实验3中开始浓度大,浓度越大反应速率越快,则 v3>v1(填<、或=),且c3>2.0mol/L,
故答案为:>;>.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、温度和浓度及平衡的影响、速率计算为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
相关题目
18.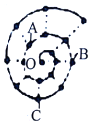 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )| A. | O与A、B、C均能形成两种化合物 | |
| B. | A元素位于元素周期表ⅥA族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | B、C最高价氧化物的水化物可以相互反应 |
19.下列叙述不正确的是( )
| A. | 醋酸纤维属于酯类 | |
| B. | 顺-2-丁烯与反-2-丁烯的沸点不同 | |
| C. | 脱氧核糖核酸(DNA)是高分子有机物 | |
| D. | 由苯酚与溴水的反应可知,苯环影响了羟基 |
12.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 25℃、1.01×105 Pa下,44g CO2中含有的原子数为3NA | |
| C. | 1 L 0.5mol/L Na2CO3 溶液中含有的CO32-数目为0.5NA | |
| D. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA |
13.下列关于仪器使用和操作说法不正确的是( )
| A. | 蒸发时,给蒸发皿内液体加热时,液体不超过容器的$\frac{2}{3}$ | |
| B. | 蒸馏操作时,冷凝管中进冷凝水应是“下进上出” | |
| C. | 盛放NaOH溶液时,使用带橡胶塞的磨口瓶 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度比水大 |
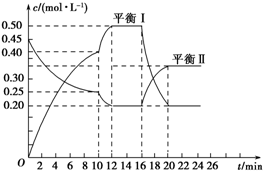 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0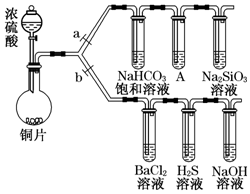 根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).
根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).