题目内容
4.设NA代表阿伏加罗常数的值,下列叙述正确的是( )| A. | 标准状况下,由H2O2制得2.24L O2转移的电子数为0.4NA | |
| B. | 精炼铜,若阳极失去2NA个电子,则阴极增重64g | |
| C. | NO2和H2O反应生成2mol HNO3时转移的电子数为4NA | |
| D. | 常温常压下,11.2L NH3中所含氮原子数为0.5NA |
分析 A、由双氧水制取氧气时,氧元素由-1价变为0价;
B、精炼铜时,阴阳极上得失电子数相同,且阴极上是铜离子放电;
C、NO2和H2O反应生成 HNO3的反应转移2mol电子;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、由双氧水制取氧气时,氧元素由-1价变为0价,故当生成标况下2.24L氧气即0.1mol氧气时,反应转移0.2NA个电子,故A错误;
B、精炼铜时,阴阳极上得失电子数相同,故阳极失去2NA个电子,阴极得到2NA个电子,且阴极上是铜离子放电Cu2++2e-=Cu,故当得2NA个电子即2mol电子时,阴极上析出1mol铜,质量为64g,故B正确:
C、NO2和H2O反应生成 HNO3的反应转移2mol电子,生成2mol硝酸,即当生成2mol硝酸时转移2NA个电子,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氨气的物质的量小于0.5mol,则含有的氮原子个数小于0.5NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
14.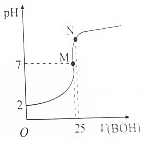 25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )
25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )
 25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )
25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )| A. | BA溶液呈碱性 | |
| B. | 酸HA的电离常数约为0.0011 | |
| C. | M点时,c(B+)=c(A-)>c(H+)=c(OH-) | |
| D. | N点时加入10mL0.1000mol•L-1HA溶液,将促进A-的水解 |
15.下列有关化学用语表达不正确的是( )
| A. | Na的原子结构示意图: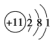 | |
| B. | 含有6个质子和7个中子的碳元素的核素符号:${\;}_{6}^{13}$C | |
| C. | 氮气的电子式::N:::N: | |
| D. | 用电子式表示氧化钠的形成过程: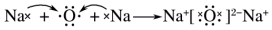 |
12.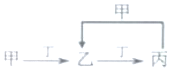 已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
 已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )| A. | 氢化物的稳定性:Z>Y | B. | 离子半径:Z>Y>X | ||
| C. | W可能是金属元素 | D. | W和X均能与Y形成两种离子化合物 |
19.下列叙述不正确的是( )
| A. | 醋酸纤维属于酯类 | |
| B. | 顺-2-丁烯与反-2-丁烯的沸点不同 | |
| C. | 脱氧核糖核酸(DNA)是高分子有机物 | |
| D. | 由苯酚与溴水的反应可知,苯环影响了羟基 |
5.给150mL某液体加热的操作中,所需的仪器是( )
①试管;②烧杯;③酒精灯;④试管夹;⑤石棉网;⑥泥三角;⑦坩埚;⑧三脚架.
①试管;②烧杯;③酒精灯;④试管夹;⑤石棉网;⑥泥三角;⑦坩埚;⑧三脚架.
| A. | ③⑥⑦⑧ | B. | ②③⑤⑧ | C. | ①③④⑤ | D. | ②③⑤⑥ |
12.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 25℃、1.01×105 Pa下,44g CO2中含有的原子数为3NA | |
| C. | 1 L 0.5mol/L Na2CO3 溶液中含有的CO32-数目为0.5NA | |
| D. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA |
10.向混合溶液甲中缓慢滴加溶液乙,反应生成沉淀的质量如图所示,其中可能符合图象的一组是( )
| 甲 | 乙 | 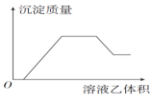 | |
| A | NH4NO3、Al(NO3)3、HCl、Fe(NO3)3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| D | NaAlO2、NH3•H2O、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
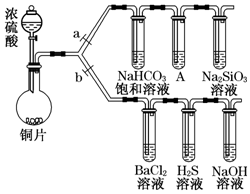 根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).
根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).