��Ŀ����
19��������ˮ��Һ�п��ܴ��ڵ���ƽ�⡢�ε�ˮ��ƽ�������ܽ�ƽ�⣬���Ƕ��ɿ�����ѧƽ���һ�֣��������ѧ��ѧ֪ʶ�ش��������⣺��1��0.2mol•L-1�ģ�NH4��Al��SO4��2��Һ������Ũ���ɴ�С��˳��Ϊc��SO42-����c��NH4+����c��Al3+����c��H+����c��OH-����
��2��0.1mol•L-1��NaHCO3��Һ��NaHCO3�ڸ���Һ�д��ڵĻ�ѧƽ���У������ӷ���ʽ��ʾ��HCO3-+H2O?H2CO3+OH-��HCO3-?H++CO32-��H2O?H++OH-
��3��0.1mol•L-1�ģ�NH4��2Fe��SO4��2��Һ����ͬŨ�ȵģ�NH4��2SO4��Һ��Ƚϣ�NH4��2Fe��SO4��2�������ʵĻ�ѧʽ����Һ��NH4+��Ũ�ȸ�����ԭ����NH4+��Fe2+��ˮ������ԣ�ˮ�������
��4��д���Ȼ�����Һ��̼������Һ��Ӧ�����ӷ���ʽ��?2Fe3++3CO32-+3H2O=2Fe��OH��3��+3CO2 ??��
��5����������Һ���ɺ������յõ��IJ�����Fe2O3��������������ˮ������Fe��OH��3��HNO3����Ӧ����ʽΪFe��NO3��3+3H2O?Fe��OH��3+3HNO3��HNO3���лӷ��ԣ����ȴٽ�HNO3�ӷ����Ӷ��ٽ��Ȼ���ˮ�⣬����ʱ�õ�����Fe��OH��3������Fe��OH��3�õ�Fe2O3
��6��AlCl36H2O������SOSl2��ϼ��ȿɵõ���ˮAlCl3��SOCl2��������SOCl2��ˮ��Ӧ�ȿɼ���ˮ���������ɵ�HCl��������AlCl3��ˮ��
��7����֪Ksp[Cu��OH��2]=2.2��10-20��Ksp[Fe��OH��2]=8.0��10-16��Ksp[Fe��OH��3]=4.0��10-38������ȥ��������ͭ��Һ�е����������������ʣ����ȼ��������Լ��е�C��
A�����Ը��������ҺB��������ˮC��30%����������ҺD��ϡ����E��Ũ����
�ټ���������CuO��Cu��OH��2��CuCO3���ѧʽ�����������֣��е�ijһ�����ʣ����˼��ɣ�
���� ��1��0.2mol•L-1�ģ�NH4��Al��SO4��2��Һ��笠���������ˮ�⣬��ˮ���Դ���������������������ˮ��̶ȴ���笠���c��Al3+����c��NH4+����
��2����NaHCO3��Һ�д���̼��������ӵ�ˮ��ƽ�⡢����ƽ���ˮ�ĵ���ƽ�⣻
��3���������Ӻ�笠�ˮ��������ԣ���������ˮ������笠���ˮ�⣬��NH4��2Fe��SO4��2��Һ��c��NH4+���Դ��Դ˽����⣻
��4��̼������Һ�����Ȼ�����Һ����˫ˮ���������������Ͷ�����̼��ˮ��
��5��Fe��NO3��3��ǿ�������Σ����ȹ����з���ˮ������Fe��OH��3��HNO3��HNO3���лӷ��ԣ����ȴٽ�HNO3�ӷ����Ӷ��ٽ��Ȼ���ˮ�⣬����ʱ�õ�����Fe��OH��3������Fe��OH��3�õ�Fe2O3��
��6����SOCl2��AlCl3•6H2O��Ϲ��ȣ��ɵ���ˮAlCl3������SOCl2��ˮ��Ӧ�ȼ���ˮ���������ɵ�HCl��������AlCl3��ˮ�⣻
��7��������������ܹ����������������������ӣ����Ҳ��ܴ������ʣ�
������ҺpH�Ĺ����У���������ʼ��ܹ��������ӷ�Ӧ���ֲ��������ʣ���Ӻ�ͭԪ�ص������������ӷ�Ӧ�ٽ�������ˮ��ת��Ϊ������
��� �⣺��1��0.2mol•L-1�ģ�NH4��Al��SO4��2��Һ��笠���������ˮ�⣬��ˮ���Դ���������������������ˮ��̶ȴ���笠���c��Al3+����c��NH4+������Һ������Ũ���ɴ�С��˳��Ϊ��c��SO42-����c��NH4+����c��Al3+����c��H+����c��OH-����
�ʴ�Ϊ��c��SO42-����c��NH4+����c��Al3+����c��H+����c��OH-����
��2����NaHCO3��Һ����̼��������ӵ�ˮ��ƽ��Ϊ��HCO3-+H2O?H2CO3+OH-������ƽ�⣺HCO3-?H++CO32-��ˮ�ĵ���ƽ��H2O?H++OH-��
�ʴ�Ϊ��HCO3-+H2O?H2CO3+OH-��HCO3-?H++CO32-��H2O?H++OH-��
��3����NH4��2Fe��SO4��2��NH4+��Fe2+��ˮ������ԣ�ˮ������ƣ���ˣ�NH4��2Fe��SO4��2��NH4+��ˮ��̶ȣ�NH4��2SO4��ҪС����NH4��2Fe��SO4��2�ȣ�NH4��2SO4��c��NH4+����
�ʴ�Ϊ����NH4��2Fe��SO4��2��NH4+��Fe2+��ˮ������ԣ�ˮ������ƣ�
��4��̼������Һ�����Ȼ�����Һ����˫ˮ�⣬���ӷ���ʽΪ?2Fe3++3CO32-+3H2O=2Fe��OH��3��+3CO2 ??����
�ʴ�Ϊ��?2Fe3++3CO32-+3H2O=2Fe��OH��3��+3CO2 ??����
��5��Fe��NO3��3��ǿ�������Σ����ȹ����з���ˮ������Fe��OH��3��HNO3����Ӧ����ʽΪFe��NO3��3+3H2O?Fe��OH��3+3HNO3��HNO3���лӷ��ԣ����ȴٽ�HNO3�ӷ����Ӷ��ٽ��Ȼ���ˮ�⣬����ʱ�õ�����Fe��OH��3������Fe��OH��3�õ�Fe2O3����Ӧ����ʽΪ2Fe��OH��3$\frac{\underline{\;\;��\;\;}}{\;}$Fe2O3+3H2O���������յõ��Ĺ�����Fe2O3��
�ʴ�Ϊ��Fe2O3��������ˮ������Fe��OH��3��HNO3����Ӧ����ʽΪFe��NO3��3+3H2O?Fe��OH��3+3HNO3��HNO3���лӷ��ԣ����ȴٽ�HNO3�ӷ����Ӷ��ٽ��Ȼ���ˮ�⣬����ʱ�õ�����Fe��OH��3������Fe��OH��3�õ�Fe2O3��
��6��SOCl2��ˮ��Ӧ���ɵ��Ȼ������Ȼ���ˮ�����������ã���Ӧ�Ļ�ѧ����ʽΪ��SOCl2+H2O=2HCl��+SO2��������AlCl3��Һ���ܵõ���ˮAlCl3��ʹSOCl2��AlCl3•6H20��ϲ����ȣ��ɵõ���ˮAlCl3��SOCl2��ˮ��Ӧ���ɵ��Ȼ������Ȼ���ˮ�����������ã�
�ʴ�Ϊ��SOCl2��ˮ��Ӧ�ȿɼ���ˮ���������ɵ�HCl��������AlCl3��ˮ�⣻
��7������ȥ��������ͭ��Һ�е����������������ʣ����ᴿʱΪ�˳�ȥFe2+�������������������������H2O2���仹ԭ������ˮ�������ʣ�
A��KMnO4�����������ӣ���A����
B��Cl2 ��ˮ��Ӧˮ�����������ӣ���B����
C��30%����������Һ�����������µ����ʣ����������������ӣ���C��ȷ��
D��ϡ����������������ӣ���D����
E��Ũ��������ˮ���ȴٽ�ˮ�⣬�����ƣ���E����
�����ʵ����ʵ�������ҺpH=4��ʹFe3+ת��ΪFe��OH��3��Ϊ����������ʣ���ѡ��CuO��Cu��OH��2��CuCO3�ȣ�
�ʴ�Ϊ��C��CuO��Cu��OH��2��CuCO3��
���� ���⿼��������ˮ���Ӧ�ã���Һ������Ũ�ȴ�С�ıȽϣ���Һ��ƽ��ķ�������Һ���Ƶ�֪ʶ��ע��֪ʶ�Ĺ��ɺ������ǹؼ�����Ŀ�Ѷ��еȣ�

 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д� ����νӽ̲���ĩ���Ԥϰ�人������ϵ�д�
����νӽ̲���ĩ���Ԥϰ�人������ϵ�д� ������ҵ��ٳɳ����½������������ϵ�д�
������ҵ��ٳɳ����½������������ϵ�д�| �� | �� |  | |
| A | NH4NO3��Al��NO3��3��HCl��Fe��NO3��3 | NaOH | |
| B | Na2CO3��NH4HCO3��Na2SO4 | Ba��OH��2 | |
| C | AlCl3��Mg��NO3��2��HNO3 | NaOH | |
| D | NaAlO2��NH3•H2O��NaOH | H2SO4 |
| A�� | A | B�� | B | C�� | C | D�� | D |
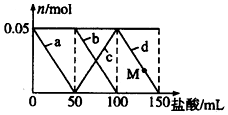 ��Na2CO3��NaAlO2�Ļ����Һ����μ���150mL 1mol•L-1��HCl��Һ�������Һ�е�ij�����������ʵ����ı仯��ͼ��ʾ��������˵����ȷ���ǣ�������
��Na2CO3��NaAlO2�Ļ����Һ����μ���150mL 1mol•L-1��HCl��Һ�������Һ�е�ij�����������ʵ����ı仯��ͼ��ʾ��������˵����ȷ���ǣ�������| A�� | a���߱�ʾ�����ӷ���ʽΪ��AlO2-+H++H2O=Al��OH��3 | |
| B�� | b��c���߱�ʾ�����ӷ�Ӧ����ͬ�� | |
| C�� | M��ʱAl��OH��3������С��3.9g | |
| D�� | ԭ�����Һ�е�CO32-��AlO2-�����ʵ���֮��Ϊ2��1 |
CO2��g��+C��s���T2CO��g����H1
CO��g��+$\frac{1}{2}$O2��s���TCO2��g����H2
C��s��+O2��g���TCO2��g����H3
CuO��s��+CO��g���TCu��s��+CO2��g����H4
2CuO��s��+C��s���T2Cu��s��+CO2��g����H5
���й���������Ӧ�ʱ���ж���ȷ���ǣ�������
| A�� | ��H1��0 | B�� | ��H2��0 | C�� | ��H1=��H3-2��H2 | D�� | 2��H4����H5 |
| A�� | 1mol�κ����ʶ�����6.02��1023������ | |
| B�� | ����ͬ�����£���ͬ���ʵ���CO��N2�Ļ��������O2�ķ��Ӹ�����ͬ��ԭ�Ӹ���Ҳ��ͬ | |
| C�� | NaOH��Ħ������40g | |
| D�� | �ڱ�״���£�1molO2��1molSO3�������ͬ |
| A�� | 1 �� | B�� | 2 �� | C�� | 3 �� | D�� | 4 �� |
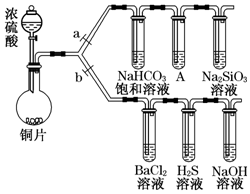 ����Ҫ���������ʵ����̣�a��bΪ���ɼУ����ȼ��̶�װ������ȥ����
����Ҫ���������ʵ����̣�a��bΪ���ɼУ����ȼ��̶�װ������ȥ����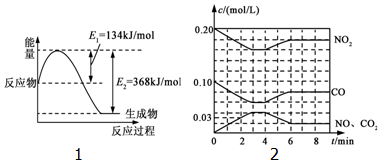 ���Ŵ�����Ⱦ���������أ������ܼ��š�������ȫ�����������ŷţ��о�NOx��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
���Ŵ�����Ⱦ���������أ������ܼ��š�������ȫ�����������ŷţ��о�NOx��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮