题目内容
17. 将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将b g(a>b)粉末状碳酸钙与同浓度的足量盐酸反应(图中虚线所示),则相应的曲线正确的是( )
将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将b g(a>b)粉末状碳酸钙与同浓度的足量盐酸反应(图中虚线所示),则相应的曲线正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 由题意可知,图中实线表示的块状的碳酸钙与足量的盐酸反应,虚线所示粉末状碳酸钙与同浓度的盐酸反应,利用接触面积对反应速率的影响来解答.
解答 解:固体表面积越大,则反应速率越大,加入粉末状碳酸钙与同浓度盐酸反应,较块状碳酸钙反应速率大,即相同时间内虚线所示的曲线对应的损失的质量大,因为 a>b导致最终损失的质量a>b,由图象可知,只有C符合,故选C.
点评 本题考查影响化学反应速率的因素及图象分析,为高频考点,明确接触面积对反应速率的影响及盐酸足量时参加反应的碳酸钙的质量相同是解答本题的关键,难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
12.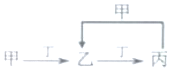 已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
 已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )| A. | 氢化物的稳定性:Z>Y | B. | 离子半径:Z>Y>X | ||
| C. | W可能是金属元素 | D. | W和X均能与Y形成两种离子化合物 |
5.给150mL某液体加热的操作中,所需的仪器是( )
①试管;②烧杯;③酒精灯;④试管夹;⑤石棉网;⑥泥三角;⑦坩埚;⑧三脚架.
①试管;②烧杯;③酒精灯;④试管夹;⑤石棉网;⑥泥三角;⑦坩埚;⑧三脚架.
| A. | ③⑥⑦⑧ | B. | ②③⑤⑧ | C. | ①③④⑤ | D. | ②③⑤⑥ |
12.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 25℃、1.01×105 Pa下,44g CO2中含有的原子数为3NA | |
| C. | 1 L 0.5mol/L Na2CO3 溶液中含有的CO32-数目为0.5NA | |
| D. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA |
2.除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是( )
| 选项 | 物质 | 选用的试剂 | 操作方法 |
| ① | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| ② | CO2(CO) | 氧气 | 点燃 |
| ③ | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| ④ | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
6.以下反应中,Q1>Q2的是(Q指反应放出的热量)( )
| A. | S(s)+O2(g)→SO2(g) Q1 kJ; S(g)+O2(g)→SO2(g) Q2 kJ | |
| B. | 2H2(g)+O2(g)→2H2O(g) Q1kJ; 2H2(g)+O2(g)→2H2O(l) Q2kJ | |
| C. | NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(l) Q1kJ; NaOH(aq)+CH3COOH(aq)→CH3COONa(aq)+H2O(l) Q2 kJ | |
| D. | H2(g)+Cl2(g)→2HCl(g) Q1kJ; H2(g)+F2(g)→2HF(g) Q2kJ |
7.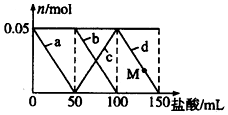 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3 | |
| B. | b和c曲线表示的离子反应是相同的 | |
| C. | M点时Al(OH)3的质量小于3.9g | |
| D. | 原混合溶液中的CO32-与AlO2-的物质的量之比为2:1 |

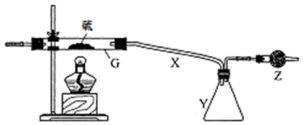
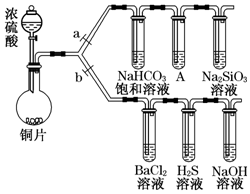 根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).
根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).