题目内容
将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应.求:
(1)所用盐酸中HCl的物质的量浓度
(2)反应中生成的H2在标准状况下的体积
(3)在反应后的溶液中通入Cl2,写出所发生反应的化学方程式并用双线桥标出电子转移的方向和数目: .
(1)所用盐酸中HCl的物质的量浓度
(2)反应中生成的H2在标准状况下的体积
(3)在反应后的溶液中通入Cl2,写出所发生反应的化学方程式并用双线桥标出电子转移的方向和数目:
考点:化学方程式的有关计算
专题:计算题
分析:n(Fe)
=0.2mol,发生Fe+2HCl=FeCl2+H2↑,以此计算(1)、(2);反应后的溶液中通入Cl2,发生Cl2+2FeCl2═2FeCl3,以此来解答.
| 11.2g |
| 56g/mol |
解答:
解:n(Fe)
=0.2mol,发生Fe+2HCl=FeCl2+H2↑,
(1)n(HCl)=2n(Fe)=0.4mol,则c(HCl)=
=0.2mol/L,
答:所用盐酸中HCl的物质的量浓度为0.2mol/L;
(2)n(H2)=n(Fe)=0.2mol,标况下体积为0.2mol×22.4L/mol=4.48L,
答:生成的H2在标准状况下的体积为4.48L;
(3)反应后的溶液中通入Cl2,发生Cl2+2FeCl2═2FeCl3,转移2e-,则用双线桥标出电子转移的方向和数目为 ,
,
故答案为: .
.
| 11.2g |
| 56g/mol |
(1)n(HCl)=2n(Fe)=0.4mol,则c(HCl)=
| 0.4mol |
| 0.2L |
答:所用盐酸中HCl的物质的量浓度为0.2mol/L;
(2)n(H2)=n(Fe)=0.2mol,标况下体积为0.2mol×22.4L/mol=4.48L,
答:生成的H2在标准状况下的体积为4.48L;
(3)反应后的溶液中通入Cl2,发生Cl2+2FeCl2═2FeCl3,转移2e-,则用双线桥标出电子转移的方向和数目为
 ,
,故答案为:
 .
.
点评:本题考查化学反应方程式的计算,为高频考点,把握发生的氧化还原反应为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
原子弹是一种主要利用235U或239Pu等重原子核的裂变制成的武器,Pu为94号元素,则239Pu核内的中子数为( )
| A、51 | B、94 |
| C、141 | D、145 |
下述实验能达到预期目的是( )
| A、检验乙醛中的醛基:在一定量CuSO4溶液中,加入少量NaOH溶液,然后再加入乙醛,加热产生砖红色沉淀 |
| B、分离提纯苯:向苯和苯酚混合溶液中加入足量浓溴水,静置后分液 |
| C、比较CH3COO-和CO32-结合H+的能力:相同温度下,测定浓度均为0.1mol?L-1的Na2CO3和CH3COONa溶液的pH |
| D、检验溴乙烷中的溴元素:向某溴乙烷中加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |




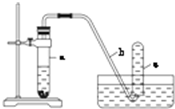 用如图所示的装置进行实验:
用如图所示的装置进行实验: 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为 一定条件下,在容积为1L的密闭容器中发生可逆反应:Fe(s)+H2O(g)═FeO(s)+H2(g)△H>0.在1000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示.
一定条件下,在容积为1L的密闭容器中发生可逆反应:Fe(s)+H2O(g)═FeO(s)+H2(g)△H>0.在1000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示. 取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL.
取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL.