题目内容
 取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL.
取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL.(1)在 NaOH 溶液中通入一定量的 CO2后,溶液中溶质的组成可能是:
①:
(2)在稀释后的溶液中分别逐滴加 0.1mol/L 的盐酸,产生的 CO2的体积(标准状况)
与所加盐酸的体积关系如图所示:
①分别加入足量的盐酸后的溶液中的溶质是
②A 曲线表明,原溶液通入 CO2后,所得溶质与 HCl 反应产生 CO2的最大体积是
③B 曲线表明,原溶液通入 CO2后,所得溶质的化学式为
考点:化学方程式的有关计算,钠的重要化合物
专题:图示题,计算题
分析:(1)由CO2+2NaOH═Na2CO3+H2O、CO2+NaOH═NaHCO3,及气体的量确定固体的成分;
(2)由图可知,A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积60mL远远大于碳酸氢钠生成氯化钠需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是NaOH和Na2CO3,
对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积25mL小于碳酸氢钠生成氯化钠需要盐酸的体积(75-25)mL=50mL,说明原溶液中的溶质是Na2CO3和NaHCO3,
①加入足量的盐酸后的溶液中均只存在NaCl,n(HCl)=n(NaOH),结合c=
计算;
②逐滴加入0.1mol?L-1 的盐酸,生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸15mL时有气体生成,利用HCO3-+H+=H2O+CO2↑计算;
③溶质是Na2CO3和NaHCO3,由消耗盐酸的关系可知,二者的物质的量相同.
(2)由图可知,A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积60mL远远大于碳酸氢钠生成氯化钠需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是NaOH和Na2CO3,
对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积25mL小于碳酸氢钠生成氯化钠需要盐酸的体积(75-25)mL=50mL,说明原溶液中的溶质是Na2CO3和NaHCO3,
①加入足量的盐酸后的溶液中均只存在NaCl,n(HCl)=n(NaOH),结合c=
| n |
| V |
②逐滴加入0.1mol?L-1 的盐酸,生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸15mL时有气体生成,利用HCO3-+H+=H2O+CO2↑计算;
③溶质是Na2CO3和NaHCO3,由消耗盐酸的关系可知,二者的物质的量相同.
解答:
解:(1)由CO2+2NaOH═Na2CO3+H2O、CO2+NaOH═NaHCO3,二氧化碳少量时固体为①Na2CO3和NaOH;以1:2恰好反应时为②Na2CO3;物质的量比介于1:1~1:2之间为③Na2CO3和NaHCO3;二氧化碳过量时为④NaHCO3,
故答案为:Na2CO3和NaOH;Na2CO3;Na2CO3和NaHCO3;NaHCO3;
(2)由图可知,A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积60mL远远大于碳酸氢钠生成氯化钠需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是NaOH和Na2CO3,
对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积25mL小于碳酸氢钠生成氯化钠需要盐酸的体积(75-25)mL=50mL,说明原溶液中的溶质是Na2CO3和NaHCO3,
①加入足量的盐酸后的溶液中均只存在NaCl,n(HCl)=n(NaOH)=0.075L×0.1mol/L=0.0075mol,c(NaOH)=
=
=0.15mol/L,
故答案为:NaCl;0.15mol/L;
②对于A溶液来说,滴加盐酸15mL时有气体生成,逐滴加入0.1mol?L-1 的盐酸,当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,
则HCO3-+H+=H2O+CO2↑
1 1
n(CO2)=0.015L×0.1mol/L=0.0015mol,标况下体积为0.0015mol×22.4L/mol=0.0336L=33.6mL,
故答案为:33.6;
③由上述分析可知,B中溶质是Na2CO3和NaHCO3,由消耗盐酸的关系可知,二者的物质的量相同,即物质的量比为1:1,故答案为:Na2CO3和NaHCO3;1:1.
故答案为:Na2CO3和NaOH;Na2CO3;Na2CO3和NaHCO3;NaHCO3;
(2)由图可知,A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积60mL远远大于碳酸氢钠生成氯化钠需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是NaOH和Na2CO3,
对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积25mL小于碳酸氢钠生成氯化钠需要盐酸的体积(75-25)mL=50mL,说明原溶液中的溶质是Na2CO3和NaHCO3,
①加入足量的盐酸后的溶液中均只存在NaCl,n(HCl)=n(NaOH)=0.075L×0.1mol/L=0.0075mol,c(NaOH)=
| n |
| V |
| 0.0075mol |
| 0.05L |
故答案为:NaCl;0.15mol/L;
②对于A溶液来说,滴加盐酸15mL时有气体生成,逐滴加入0.1mol?L-1 的盐酸,当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,
则HCO3-+H+=H2O+CO2↑
1 1
n(CO2)=0.015L×0.1mol/L=0.0015mol,标况下体积为0.0015mol×22.4L/mol=0.0336L=33.6mL,
故答案为:33.6;
③由上述分析可知,B中溶质是Na2CO3和NaHCO3,由消耗盐酸的关系可知,二者的物质的量相同,即物质的量比为1:1,故答案为:Na2CO3和NaHCO3;1:1.
点评:本题考查化学反应方程式的计算,为高频考点,把握发生的氧化还原反应为解答的关键,侧重分析与计算能力、图象与反应对应关系判断能力的考查,注意根据图中盐酸的体积计算出NaOH、CO2的物质的量,判断CO2与NaOH反应过程,题目难度较大.

练习册系列答案
相关题目
下列有机物的分离提纯方法正确的是( )
| A、除去乙酸乙酯中含有的乙酸杂质,可以加氢氧化钠溶液充分振荡后,分液 |
| B、用重结晶的方法分离苯甲酸和氯化钠的混合物 |
| C、将工业酒精直接蒸馏可以获得无水酒精 |
| D、用酸性高锰酸钾溶液可以除掉甲烷中的乙烯杂质 |
现有X、Y两种第ⅤA族元素,下列事实不能说明X的非金属性比Y强的是( )
| A、两种元素所形成的酸的酸性:H3XO4>H3YO4 |
| B、两种元素所形成的气态氢化物的稳定性:XH3>YH3 |
| C、两种元素所形成的最高价氧化物的稳定性:X2O5>Y2O5 |
| D、两种元素所形成的气态氢化物的还原性:YH3>XH3 |
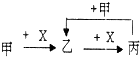 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )| A、甲:Na、X:O2 |
| B、甲:NaOH溶液、X:CO2溶液 |
| C、甲:C、X:O2 |
| D、甲:AlCl3溶液、X:NaOH溶液 |

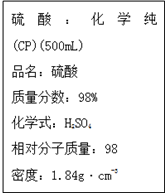 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:
 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析: