题目内容
下列坐标轴中的x表示元素的核电核数,其中y能表示F-、Na+、Mg2+、Al3+、S2-、Cl-的离子半径的是( )
A、 |
B、 |
C、 |
D、 |
考点:微粒半径大小的比较
专题:元素周期律与元素周期表专题
分析:核外电子数相同,则核内质子数越多,对核外电子的吸引程度越大,半径越小;电子层数越大半径越大,据此分析.
解答:
解:核外电子数相同,则核内质子数越多半径越小,则离子半径为:F->Na+>Mg2+>Al3+;S2->Cl-,所以半径:S2->Cl->F->Na+>Mg2+>Al3+;则离子半径随着原子序数的递增先减小,后突然增大,再减小;C项的图象符合;
故选C.
故选C.
点评:本题考查了离子半径的变化规律,注意根据电子层数和原子序数两个方面考虑,题目难度不大.

练习册系列答案
相关题目
下列不可能是乙烯加成产物的是( )
| A、CH3CH3 |
| B、CH3CHBr2 |
| C、CH3CH2OH |
| D、CH3CH2Cl |
广州亚运会严查兴奋剂.对苯丙酸诺龙是一种兴奋剂,结构简式如图,下列关于该物质的说法正确的是( )


| A、其分子式为C27H30O3,与银氨溶液发生银镜反应 |
| B、1 mol该物质与NaOH溶液反应,最多消耗2 mol |
| C、既能发生加聚反应,又能发生缩聚反应 |
| D、既可以使溴的四氯化碳溶液褪色,又可以使酸性KMnO4溶液褪色 |
下列叙述中,正确的是( )
| A、两种微粒,若核外电子排布完全相同,则其化学性质相同 |
| B、凡单原子形成的稳定离子,一定具有稀有气体元素原子的核外电子排布 |
| C、K+与Cl-通过静电引力结合形成离子化合物KCl |
| D、离子化合物中可以含有共价键,但共价化合物中一定不含离子键 |
下列物质既能导电又是强电解质的是( )
| A、氯化钠溶液 |
| B、氢氧化钠晶体 |
| C、液态硝酸钾 |
| D、液态氯化氢 |
下列说法正确的是( )
| A、元素周期表中一共有7个周期和18个族 |
| B、金属元素的原子最外层电子数一定都小于4 |
| C、质量数相同的两种原子,一定不互为同位素 |
| D、主族元素X的原子序数为a,所在周期的元素种数为b,则与x同族的下一周期的元素Y的原于序数一定为a+b |
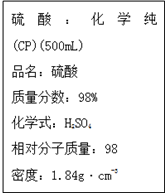 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: