题目内容
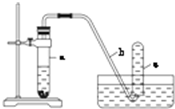 用如图所示的装置进行实验:
用如图所示的装置进行实验:(1)在检查完装置的气密性后,向试管a中加入10mL6mol/L的稀HNO3和1g Cu片,立
即用带有导管的橡皮塞塞紧试管口,请写出在试管a中有可能发生的反应的化学方程式
(2)实验过程中常常反应开始时速率缓慢,随后逐渐加快,这是由于
(3)欲较快地制得NO,可采取的措施是
A.加热 B.使用铜粉
C.稀释HNO3 D.改用浓HNO3.
考点:硝酸的化学性质,化学反应速率的影响因素
专题:元素及其化合物
分析:(1)Cu和稀硝酸反应生成硝酸铜、NO和水,NO易被氧气氧化生成二氧化氮;
(2)温度越高,反应速率越快;反应物浓度越小,其反应速率越小;
(3)温度越高反应速率越快、接触面积越大反应速率越快.
(2)温度越高,反应速率越快;反应物浓度越小,其反应速率越小;
(3)温度越高反应速率越快、接触面积越大反应速率越快.
解答:
解:(1)Cu和稀硝酸反应生成硝酸铜、NO和水,NO易被氧气氧化生成二氧化氮,所以涉及的反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、2NO+O2=2NO2,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、2NO+O2=2NO2;
(2)温度越高,反应速率越快;反应物浓度越小,其反应速率越小,该反应是放热反应,放出的热量使环境温度升高,所以反应速率加快,但随着反应的进行,硝酸的浓度降低,其反应速率减小,故答案为:该反应放热,使温度升高,故反应速率加快;反应一段时间后HNO3浓度降低,故反应速率又逐渐减小
;
(3)A.温度越高反应速率越快,所以升高温度增大反应速率,故A正确;
B.接触面积越大反应速率越快,所以使用铜粉增大反应速率,故B正确;
C.稀释硝酸,硝酸浓度减小,反应速率降低,故C错误;
D.使用浓硝酸,浓硝酸和铜反应生成二氧化氮而不是NO,故D错误;
故选AB.
(2)温度越高,反应速率越快;反应物浓度越小,其反应速率越小,该反应是放热反应,放出的热量使环境温度升高,所以反应速率加快,但随着反应的进行,硝酸的浓度降低,其反应速率减小,故答案为:该反应放热,使温度升高,故反应速率加快;反应一段时间后HNO3浓度降低,故反应速率又逐渐减小
;
(3)A.温度越高反应速率越快,所以升高温度增大反应速率,故A正确;
B.接触面积越大反应速率越快,所以使用铜粉增大反应速率,故B正确;
C.稀释硝酸,硝酸浓度减小,反应速率降低,故C错误;
D.使用浓硝酸,浓硝酸和铜反应生成二氧化氮而不是NO,故D错误;
故选AB.
点评:本题以铜和硝酸的反应为载体考查了影响反应速率的因素,明确温度、浓度、接触面积等对反应速率的影响,但决定物质反应速率的是物质本身的性质.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在高温下,将氯化铵晶体加入处于平衡状态的合成氨反应时,平衡不发生移动 |
| B、在密闭容器中,当CaCO3(s)?CaO(s)+CO2(g)处于平衡状态时,再加入Na2O2固体CaCO3的量会减少 |
| C、有固体参加的可逆反应达平衡后,若改变压强,不会影响平衡的移动 |
| D、在合成氨反应中,使用催化剂能提高反应速率,使氨的质量分数增加,从而增加氨的产量 |
下列叙述中,正确的是( )
| A、两种微粒,若核外电子排布完全相同,则其化学性质相同 |
| B、凡单原子形成的稳定离子,一定具有稀有气体元素原子的核外电子排布 |
| C、K+与Cl-通过静电引力结合形成离子化合物KCl |
| D、离子化合物中可以含有共价键,但共价化合物中一定不含离子键 |
下列说法正确的是( )
| A、元素周期表中一共有7个周期和18个族 |
| B、金属元素的原子最外层电子数一定都小于4 |
| C、质量数相同的两种原子,一定不互为同位素 |
| D、主族元素X的原子序数为a,所在周期的元素种数为b,则与x同族的下一周期的元素Y的原于序数一定为a+b |
 X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.
X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M. 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析: