题目内容
 一定条件下,在容积为1L的密闭容器中发生可逆反应:Fe(s)+H2O(g)═FeO(s)+H2(g)△H>0.在1000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示.
一定条件下,在容积为1L的密闭容器中发生可逆反应:Fe(s)+H2O(g)═FeO(s)+H2(g)△H>0.在1000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示.(1)写出该反应的平衡常数表达式K=
(2)在1 000℃时,若向上述容器中加入0.80mol铁粉和1.00mol水蒸气,达到平衡时,容器中c(H2)=
考点:化学平衡常数的含义,化学平衡的计算
专题:化学平衡专题
分析:(1)平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;化学平衡常数只与温度有关;△H>0,反应吸热,升高温度,化学平衡向正反应方向移动,生成物浓度增大,反应物浓度减小,化学平衡常数增大;
(2)根据题目给出的转化率计算c(H2).
(2)根据题目给出的转化率计算c(H2).
解答:
解:(1)平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,由于Fe和FeO属于固体,则K=
;化学平衡常数只与温度有关,温度不变,K不变;△H>0,反应吸热,升高温度,化学平衡向正反应方向移动,生成物浓度增大,反应物浓度减小,化学平衡常数增大,
故答案为:
、不变、增大;
(2)1.00mol水蒸气在容器中浓度为
=
=1mol/L,转化率为0.6,即c(H2)=△c(H2O)=1mol/L×0.6=0.6mol/L,
故答案为:0.6 mol/L.
| c(H2) |
| c(H2O) |
故答案为:
| c(H2) |
| c(H2O) |
(2)1.00mol水蒸气在容器中浓度为
| n(H2O) |
| V |
| 1.00mol |
| 1L |
故答案为:0.6 mol/L.
点评:本题考查化学平衡常数定义,难度不大,明确化学平衡常数只与温度有关,且不能用纯固体和纯液体表示.

练习册系列答案
相关题目
广州亚运会严查兴奋剂.对苯丙酸诺龙是一种兴奋剂,结构简式如图,下列关于该物质的说法正确的是( )


| A、其分子式为C27H30O3,与银氨溶液发生银镜反应 |
| B、1 mol该物质与NaOH溶液反应,最多消耗2 mol |
| C、既能发生加聚反应,又能发生缩聚反应 |
| D、既可以使溴的四氯化碳溶液褪色,又可以使酸性KMnO4溶液褪色 |
现有X、Y两种第ⅤA族元素,下列事实不能说明X的非金属性比Y强的是( )
| A、两种元素所形成的酸的酸性:H3XO4>H3YO4 |
| B、两种元素所形成的气态氢化物的稳定性:XH3>YH3 |
| C、两种元素所形成的最高价氧化物的稳定性:X2O5>Y2O5 |
| D、两种元素所形成的气态氢化物的还原性:YH3>XH3 |

 X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.
X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.
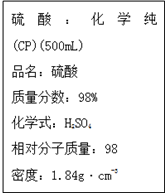 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: