题目内容
7.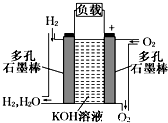 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:(1)氢气进入的这级为负极;
(2)写出氢氧燃料电池工作时电极反应方程式:负极:H2+2OH--2e-═2H2O;正极:2H2O+O2+4e-═4OH-;
(3)该氢氧燃料电池每转移0.1mol电子,消耗标准状态下0.56L氧气;
(4)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为CH4+10OH--8e-═CO32-+7H2O.
分析 (1)氢氧燃料电池中,通入燃料的电极是负极;
(2)氢氧燃料电池电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子;
(3)根据电极方程式中电子与氧气的关系求算;
(4)燃料电池中,负极上燃料失电子发生氧化反应;碱性条件下,甲烷燃烧生成碳酸根离子.
解答 解:(1)氢氧燃料电池中,通入燃料的电极是负极,即氢气进入的电极是负极,故答案为:负;
(2)氢氧燃料电池中,电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子,则其电极反应式为:2H2O+O2+4e-═4OH-;负极上是:H2+2OH--2e-═2H2O;
故答案为:负极:H2+2OH--2e-═2H2O;正极:2H2O+O2+4e-═4OH-;
(3)已知2H2O+O2+4e-═4OH-,则每转移0.1mol电子消耗的氧气为:$\frac{1}{4}$×0.1mol=0.025mol,所以V(O 2)=nVm=0.025mol×22.4L/mol=0.56L;
故答案为:0.56;
(4)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲烷在负极生成碳酸根离子,其电极反应式为:CH4+10OH--8e-═CO32-+7H2O;碱性条件下,甲烷燃烧生成的二氧化碳再与氢氧根离子结合生成碳酸根离子,则总反应方程式为:CH4+2O2+2OH-═CO32-+3H2O;
故答案为:CH4+10OH--8e-═CO32-+7H2O.
点评 本题考查学生原电池的工作原理并以原电池为载体考查了电极反应方程式的书写,该题较基础,难度不大.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
18.著名丹麦物理学家尼•玻尔(N.Bohr)将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”,化学方程式可简单表示为:Au+NHO3+3HCl═AuCl3+NO↑+2H2O,AuCl3+HCl═HAuCl4(四氯合金酸).纳粹分子对这种溶液“愚笨”得视而不见、毫无所知.战争结束后,物理学家又根据以下反应,炼出黄金并铸出更加灿烂夺目的奖章:2HAuCl4@2HCl↑+3Cl2↑+2Au.表现出伟大科学家对祖国的无比热爱和非凡智慧.下列叙述中正确的是( )
| A. | 王水能溶解黄金,但不能溶解白金 | |
| B. | HAuCl4具有很强的氧化性 | |
| C. | 盐酸有很强的还原性 | |
| D. | 浓盐酸和浓硝酸按照体积比1:3能配成王水 |
12.下列实验方案中,不能达到实验目的是( )
| 项目 | 实验目的 | 实验方案 |
| A | 验证稀硫酸和稀硝酸的氧化性强弱 | 将两块相同的铜片分别加入浓度均为2mol/L的硫酸和硝酸中,观察反应的难易程度 |
| B | 验证Cu、Fe的还原性强弱 | 将铁丝和铜丝分别插入浓硝酸中,观察反应的剧烈程度 |
| C | 验证Br、I非金属性强弱 | 将少量溴水加入KI-淀粉溶液中,观察溶液是否变蓝色 |
| D | 验证Mg、Al的金属性强弱 | 在Mg(OH)2、Al(OH)3中分别加入稀氨水,观察沉淀能否溶解 |
| A. | A | B. | B | C. | C | D. | D |
19.实验室欲制氢气,所用稀盐酸和稀硫酸的浓度相同,反应速率最快的是( )
| A. | 纯锌与稀硫酸反应 | B. | 纯锌和浓硫酸反应 | ||
| C. | 纯锌与稀盐酸反应 | D. | 粗锌(含铅、铜杂质)与稀硫酸反应 |
16.14C是碳的一种同位素原子.设N0为阿伏加德罗常数值,下列说法不正确的是( )
| A. | $\frac{1}{8}$mol 14CH4分子所含中子数为N0 | |
| B. | 7 g 14C原子形成的石墨完全燃烧生成二氧化碳时所转移的电子数为2N0 | |
| C. | 常温常压下,22.4 L含14C的二氧化碳中分子数等于N0 | |
| D. | 常温常压下,17 g甲基(-14CH3)所含电子数为9N0 |
17.几种短周期元素的原子半径及主要化合价见下表:
下列叙述正确的是( )
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、 -2 | +2 | -2 | +1 |
| A. | K、L、M三元素的金属性逐渐增强 | |
| B. | T元素的化合价除了-2价,只有0价 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物为淡黄色 |
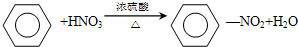 ,属于取代反应;
,属于取代反应; ,属于加成反应;
,属于加成反应; +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,属于取代反应;
+HBr,属于取代反应;
 某甲同学设计如图装置,比较非金属元素的非金属性强弱.请按要求回答下列问题:
某甲同学设计如图装置,比较非金属元素的非金属性强弱.请按要求回答下列问题: