题目内容
16.14C是碳的一种同位素原子.设N0为阿伏加德罗常数值,下列说法不正确的是( )| A. | $\frac{1}{8}$mol 14CH4分子所含中子数为N0 | |
| B. | 7 g 14C原子形成的石墨完全燃烧生成二氧化碳时所转移的电子数为2N0 | |
| C. | 常温常压下,22.4 L含14C的二氧化碳中分子数等于N0 | |
| D. | 常温常压下,17 g甲基(-14CH3)所含电子数为9N0 |
分析 A、14CH4分子中含8个中子;
B、求出7g14C的物质的量,然后根据1mol14C燃烧生成二氧化碳转移4mol电子来分析;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、求出甲基-14CH3的物质的量,然后根据1mol甲基-14CH3中含9mol电子来分析.
解答 解:A、14CH4分子中含8个中子,故$\frac{1}{8}$mol14CH4中含中子数为N0个,故A正确;
B、7g14C的物质的量为0.5mol,而1mol14C燃烧生成二氧化碳转移4mol电子,故0.5mol14C燃烧转移2mol电子即2N0个,故B正确;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化碳的物质的量小于1mol,则分子数小于N0个,故C错误;
D、17g甲基-14CH3的物质的量为1mol,而1mol甲基-14CH3中含9mol电子,故含9N0个,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.铝与100mL稀硫酸的反应中,已知30s末共收集到标况下氢气336mL,若不考虑反应过程中溶液体积的变化,则30s内生成硫酸铝的平均反应速率是( )
| A. | 0.1 mol/(L•min) | B. | 3.6 mol/(L•min) | C. | 1.2 mol/(L•min) | D. | 0.017mol/(L•min) |
4.下列关于乙烯说法正确的是( )
| A. | 乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色原理相同 | |
| B. | 工业利用乙烯水化法制乙醇,是发生了取代反应 | |
| C. | 水果运输中为延长果实的成熟期,常在车厢里放置浸泡过高锰酸钾溶液的硅藻土 | |
| D. | 乙烯在空气中燃烧,发生火焰明亮并带有浓烟的火焰 |
11.有机物 在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤酯化反应 ⑥加聚反应 ⑦缩聚反应.
 在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤酯化反应 ⑥加聚反应 ⑦缩聚反应.
| A. | ①③④ | B. | ②③④⑤ | C. | ④⑤⑥⑦ | D. | ②③④⑤⑦ |
1.下列物质与硝酸反应,既体现了硝酸具有强氧化性又体现了酸性的是( )
| A. | Cu | B. | C | C. | CuO | D. | CuCO3 |
8.下列说法中正确的是( )
| A. | 原子晶体中只含有共价键,离子晶体中只含有离子键 | |
| B. | 原子晶体的熔点一定比金属晶体的高 | |
| C. | 分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 | |
| D. | 任何晶体中,若含有阳离子就一定含有阴离子 |
6.用如图实验装置进行实验不能达到目的是( )
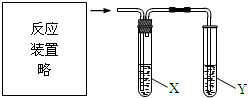
| 选项 | 反应及实验目的 | 试剂X | 试剂Y |
| A | 电石与饱和食盐水混合, 检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 |
| B | 二氧化锰与浓盐酸混合加热, 验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 |
| C | 乙醇与浓硫酸加热至170℃, 证明发生了消去反应 | NaOH溶液 | Br2的CCl4溶液 |
| D | 乙酸溶液与碳酸钠固体混合, 探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |

| A. | A | B. | B | C. | C | D. | D |
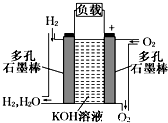 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.